Грам газ молекула - знаете как
1. Обем на грам молекула газ. закон на Авогадро
Грам молекула на всяко вещество в твърдо, течно или газообразно състояние представлява определено количество на веществото. провеждане на определена сума на пространството. С други думи, молекулата на гр има не само теглото, но и силата на звука. Този обем е доста лесно да се изчисли, като се използват формулата
P = V · г
където Р - w, в този случай теглото на мола (М), V- обем мола, и d- и специфично тегло, или плътност. За твърди вещества, се експресират в количество грама на 1 cm3, и газообразни - в грамове на 1 литър. Въз основа на тази формула, може лесно да се определи количеството на мола: V = M. г; M - лесна за научаване, изчисляване на молекулната маса на веществото. реклама - използва честотни таблици. Считаме обема при нормални условия (температура и налягане от 0 ° 760 mm Hg. V.).
Таблица. 1, които грам-молекула на всяко от веществата, изброени има различен размер, тъй като размерът на всеки молекулно вещество варира и броят на молекули на молекула грам е същото.
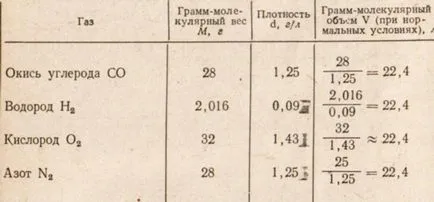
От горната таблица. 2 данни показват, че грам-молекулно обема на газ, равен на всеки друг грам-молекула на всеки газ при нормални условия заема обем от 22.4 литра.
• Запишете този номер в книгата и не забравяйте добре.
Какво е това обясни? Оказва се, че разликите между газовите молекули са толкова големи, че количеството на молекулите в сравнение с тези разстояния са незначителни, и ние можем да го игнорирате. По този начин, чрез измерване на количеството ние всъщност се измери количеството на сумата от разликите между молекулите.
Таблица 1. Грам-молекулен обем и плътност на течностите и твърдите
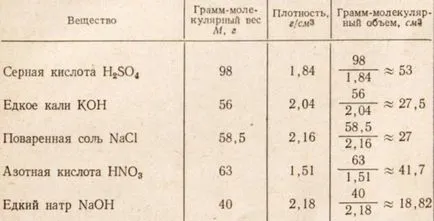
Таблица 2. грам-молекулно обем и плътност на газа
По отношение на разстоянието между молекули, зависи от условията (температура и налягане), и напълно независими от естеството на газа и неговото молекулно размер, въпреки че при същите условия, ние получаваме същия обем.
Това предполага, до следното заключение: при същите условия, каквито молове газове заемат равни обеми.
• Запишете това заключение в тетрадка.
Получените резултати са логично резултатите ни доведе до следващото: като в грам-молекула на всяко вещество съдържа същия брой молекули и грам-молекула газове заемат същия обем при същите условия, можем да заключим, че: равен обем от газове при идентични условия, съдържа един и същия брой молекули. Това заключение беше направено през 1811 г. от италианския химик Авогадро т.нар закон на Авогадро.
• Напишете текста на закона в книгата.
■ 1. Как да се изчисли сумата от моловете твърдо течност? (Вж. Response)
2. Защо обема на грам-молекули на течности и твърди вещества са различни?
3. Какво е "нормални условия"?
4. Защо обема на газ грам-молекули при същите условия са равни?
5. Каква е сумата от моловете всеки газ при нормални условия?
6. Що се формулират закона на Авогадро. (Вж. Response)
2. Изчисленията на химически формули, използващи обем на газ мола
Знаейки, че обемът на газ Грам-молекули при идентични условия, са лесни за изчисляване на обема на всяко количество газ понякога е по-важно от знанието на теглото му.
■ 12. Колко водород Н2 може да бъде изключен от солна киселина, 130 г цинк (нормални условия)? (Вж. Response)
13. Това, което е количеството на хлороводород, получен чрез взаимодействие на НО 67.2 L от водород Н2 с хлор Cl2 (нормални условия)?
14. Когато се възстановява меден оксид с водород образува 8 грам мед. Това е количеството, прекарано за реакцията на водород (нормални условия)?
15. Водороден сулфид H2S се изгарят съгласно уравнението:
2H2S + 3O2 = 2SO2 + 2H2O
Изчислява се обема на кислород и серен диоксид при изгаряне 5 мола сероводород (нормални условия).
16. Това, което е количеството на въглероден диоксид се консумира в реакция с 37 г калциев хидроксид Са (ОН) 2, ако SaSO3 карбонат (нормални условия) се образува чрез реакция? (Вж. Response)
4. абсолютната и относителната плътност газ. Определяне на молекулното тегло на газовете в абсолютна и относителна плътност
Концепцията на абсолютната и относителната плътност на газ следва директно от вече счита материал от нас за обема на газ мола.
Абсолютната плътност (или специфично тегло) на газа - е теглото на 1 литър газ. Нейната лесно да се идентифицират по формулата:
където М - грам-молекулно тегло на газа и V - обем на газ мола равен при нормални условия на 22.4 литра.
Ето защо,
Познаването на молекулното тегло. Можете да намерите абсолютната плътност. За тази формула, ако не знае истинската плътност, може да се определи молекулното тегло от формула М = 22,4m · г (нормални условия).
Относителна плътност - е абстрактно номер посочва колко пъти един газ тежки (или запалка) другата (при идентични условия).
Който може да се определя чрез сравняване на теглото на 1 литър газ (D 1) и 1 литър друг газ (D 2), т. Е. Сравнение на абсолютна плътност на тези газове.
относителната плътност на формулата ще изглежда като отношение на абсолютната плътност на газа на абсолютната плътност на друг газ:
В действителност, относителната плътност е съотношението на молекулните тегла на двете газове. химически символ на газа, който се сравнява с желаното молекулно тегло на газа е поставен точно на дъното при определянето на относителната плътност. Например, ако сложите ЦО. Това означава, че относителната плътност показва колко пъти молекулното тегло на целевия газ през молекулното тегло на водород. Ако има db, което означава, че желаното молекулно тегло на газа се сравнява със средно молекулно тегло на въздуха, което е равно на 29 в. д.
Въз основа на относителната плътност на формула
можете да идентифицирате и да е от трите променливи, ако знаете останалото. Например, възможно е да се намери на молекулното тегло на газа, като се използва формулата:
■ 17. Каква е истинската плътност? (Вж. Response)
18. Как можем да се определи молекулната маса с помощта на истинската плътност?
19. Каква е относителната плътност?
20. Derive формула относителна плътност.
21. Как да се определи молекулната маса на газа, ако е известно, относителната плътност? (Вж. Response)
5. Изчисления, базирани на концепциите за абсолютна и относителна плътност на газа. Определяне на молекулното тегло на газа и на формула
Ако знаем истинската плътност на газа, формула абсолютната плътност, получен по-горе ние лесно може да намери неговото молекулно тегло.
Пример 5: Определяне колко пъти по-тежък от въздуха хлоро.
Решение: Хлор молекулно тегло от 35.5 · 2 = 71. Средното молекулно тегло на въздуха е 29.
A: хлоро-тежък от въздуха с 2.4 пъти.
■ 22. Изчислете молекулното тегло на газа, ако теглото на газа е 1696 грама (Вж. Отговор)
23. формула газ, ако е известно, че истинска плътност от 1.25 г / л и следния състав: въглерод C ~ 43%, 57% кислород ~ 0.
24. формула газ, ако е водород плътност е 15, и има следния състав: 80% въглерод, 20% водород.
25. Коя от следните газове тежки от въздуха: H2S сероводород, флуор F2, CO2 въглероден диоксид, амоняк, NH3, Аг, Аг? (Вж. Response)