Есе "производство на фреони," платформа съдържание
1. Общ преглед на процеса на халогениране 4
2. Безопасност в халогениране обработва 9
3. химикали и теоретична основа на процеса на получаване на фреон 10
4. технологията на процеса на получаване на фреон 11
Позоваването 14
Производство на органични стана много дълго време, но първоначално тя се базира на преработката на растителни или животински суровини - (. Сапун, алкохол и други) избор на материали (захар, олио), или разделяне. Organic Synthesis, т. Е. Получаването на по-сложни вещества с относително проста, възникнали в базата страничен продукт средата на XIX век коксуващи се въглища, съдържащ ароматно съединение. След това, вече в XX век като източник на органични суровини стават все по-важна роля за нефт и природен газ, добив, транспорт и преработка, които са по-икономични от въглища. Тези три вида изкопаеми суровини се основава главно на промишлеността и органичния синтез. В процесите на физическо разделяне, или термична каталитично разцепване (коксуване, напукване, пиролиза, реформинг, превръщане), получен пет групи на изходните материали за синтез на много хиляди други съединения:
1. парафини (от метан CH4 да въглеводороди С15 - С40);
2. олефини (C2H4, C3H6, С4Н8, S5N10);
3. ароматни въглеводороди (бензол, толуол, ксилол, нафталин);
5. въглероден окис и синтетичния газ (смес от СО и Н2).
При разработването на органичния синтез индустрия беше разделена на няколко сектора (багрило технология, лекарства, пластмаси, влакна и т.н.), сред които важно място промишленост органичен и нефтохимическата синтез. Терминът "основен" (или "твърд") обхваща производството на органичния синтез mnogotonazhnyh продукти, които да служат за основа за останалата част от органичната технология. От друга страна, терминът "нефтохимически" синтеза се появи във връзка с технология органичен трансформация значение за петролев суровина в обичайния смисъл на думата (с изключение на получаване на неорганични вещества и полимери) обхваща основните химически рафиниране получени въглеводороди нефтопродукти. В тази връзка, тя е част от органичния синтез, и това се дължи на общото им отгоре.
1. Общ преглед на процеса на халогениране
1. Халогенни приготвя по три основни начина: в-премествания, монтаж и разделяне.
Заместването (заместителна) халогениране е заместване с халогенни атоми, различни атоми или групи. От тях най-важното е заместване на водородни атоми
RH + CI2 → RCI + HCI
които могат да възникнат с двете наситени и ненаситени въглеродни атома или ароматен ядро. Способността да-scheniyu заменя се съхранява в различни въглеводородни производни.
Заместването на един халогенен атом на друг е важно за получаване на флуор, бром - и yodoproizvodnyh на повече налични органохлорни съединения:
CCI4 + 2HF → CCI2F2 + 2HCI
RCI + NaBr → RBr + NaCI
Замяна на ОН - група с халогенен атом се използва за получаване на някои от халоген и киселинни хлориди:
ROH + HCI → RCI + H2O
RCOOH + COCI2 → RCOCI + СО2 + HCI
Свързване (добавка) халогениращо - присъединяване халогениращи агенти за ненаситени съединения има еднакво голямо практическо значение, като заместването. Безплатни халогени са в състояние да се присъединят към С = С S≡S и Sar-Сар:
СН2 = СН2 CI2 + → CICH2-CH2CI
CH≡CH + 2CI2 → CHCI2-CHCI2
C6H6 + 3CI2 → C6H6CI6
Халогениди са свързани двойни и тройни връзки (gidrogalogenirovanie) и олефини също реагират hlorgidrirovaniya:
СН2 = СН2 + HCI → СН3-CH2CI
CH≡CH + HCI → СН2 = CHCI
СН2 = СН2 CI2 + + H2O → CH2CI-СН2ОН + HCI
Способността на добавка към посочените по-горе реакции на халогениране запазена много производни на ненаситени въглеводороди.
Специален случай е добавка Хлорирането на свързване на хлорни атоми в долната валентно състояние, например фосген синтез от въглероден моноксид и хлор:
CO + CI2 → COCI2
реакции хлорирани разцепване стават все по-важни. От тях най-лесно настъпва дехидрохлориране (1), обратен допълнение HCI. Поради предпочитанията на тази реакция други процеси на разцепване се наблюдават само при висока температура в perhlorproizvodnyh. Това - дихлориране (2), обратната връзка CI2 и разцепването на въглерод-въглеродни връзки, които могат да се появят под действието на хлор - chlorolysis (3) или hlorinoliz или при повишена температура - пиролиза (4):
CH2CI-CH2CI СН2 = CHCI + HCI
CCI3-CCI3 CCI2 = CCI2 + CI2
CCI3-CCI3 + CI2 2CCI4
CCI3-CCI2-CCI3 CCI4 + CCI2 = CCI2
2. реакции термодинамика халогениране
реакции на халогениране, са много различни характеристики на мощност, което обуславя значителни особености. Под топлинни ефекти в сравнение реакции, включващи флуор, хлор, бром и йод за идеално държавни газ вещества:
Както се вижда от горните данни, топлинният ефект се намалява в ред F2> CI2> Br2> I2, които заемат специално място реакцията на флуориране и йодирането. Първо придружен от много висока температура по-голяма от разликата енергия на С-С и С-Н. Ако не се вземат специални мерки, това ще доведе до по-дълбоко разграждане на органична материя. От друга страна, йодиране протича много малък или дори отрицателен топлинен ефект и, за разлика от реакциите с флуор, хлор и бром, е обратима. Това, заедно с ниската активност на йод като реагент причини получават yodoproizvodnye други начини. Въпреки това, те са произведени в малък мащаб и не принадлежат към продуктите на основни органични и нефтохимическата синтез.
Термични ефекти на някои реакции, включващи халогеноводороди В идеалния газообразни вещества са, както следва:
С2Н4 + HF → C2H5F ()
С2Н4 + HCI → C2H5CI ()
С2Н4 + НВг → C2H5Br ()
С2Н4 + HI → C2H5I ()
Всички тези реакции са екзотермични и халогениди за разликата е по-малък, отколкото свободните халогени. Важно е, че всички реакции, свързани с водородни халиди са обратими.
3. халогениращи агенти
Най-високата стойност като халогениращи агенти са несъдържащи халоген и безводни водородни халиди. Техните точки на кипене при атмосферно налягане са показани в таблица 1.
Точката на кипене на халогеноводороди и халогени при атмосферно налягане
Всички те са разтворими в органични течности (Br2> CI2> F2 и НВг> HCI> HF), което е много важно за процеса на течна фаза халогениране. Има остра миризма, дразнят лигавиците на очите и дихателните пътища, и свободни халогени притежават освен задушава ефект. Особено опасни флуор и флуороводород в състояние корозия на кожата и костите.
Хлорът е получен чрез електролиза на водни разтвори на натриев хлорид (луги) едновременно се формират, когато водородът и алкален електролитни:
Na + + НО- → NaOH
Получената хлорен газ, който има концентрация ≈ 92% CI2 и съдържа примеси N2, O2 и CO. Те могат да бъдат разделени чрез втечняване на хлора, който изпаряване дава чист продукт често са по-предпочитани за хлориране процеси.
Хлороводород се получава висока температура синтез от водород и хлор:
H2 + CI2 → 2HCI
Флуорът произведени чрез електролиза на стопен калиев бифлуорид KHF2 и безводен флуороводород - действие на сярна киселина на флуорит:
CaF2 + H2SO4 → CaSO4 + 2HF
Всички халогениращи средства агресивни към материала на оборудване, както и тяхната корозивен ефект е особено увеличили в присъствието на дори следи от влага. Следователно, в методите за флуорирането на производственото оборудване използва мед или никел, и хлорирането и бромиране защита емайли тялото стомана, олово или керамични материали, също така с помощта на специални видове стомана, графит, и бита за тръби - олово. За да се намали корозия както халогениращ и органични реактиви трябва да се подложи на обезводняване.
2. Безопасност в халогениране процеси
В допълнение към общите въпроси, свързани с експлозивност и токсичност на изходните материали (въглеводороди, въглероден оксид), халогениране се извършва в редица специфични условия на безопасност.
Не само халогениращи средства, но също така да се получат производни хало често са се увеличили токсичност. Те засягат централната нервна система, има омекотяващ удара или наркотичен ефект (хлороформ, хлорал), дразнят лигавиците на очите и дихателните пътища (бензил, хлороацетон) и фосген има задушава ефект. В резултат на това в халогениране се увеличи изискванията за стягане и вентилационно оборудване магазини. На работното място са необходими първите оборудване помощ и газови маски.
Свободните халогени като кислород и въздух може да се получат въглеводород и въглероден окис експлозивни смеси. Процесът на горене в атмосфера от халоген много екзотермична и в определени концентрации продължават към експлозия. Долните и горните граници за експлозивни смеси на ниски парафини и олефини с хлор лежи в границите от 5 до 60% (об.) Въглеводород. Това налага да се вземат специални мерки за безопасност при смесване на въглеводород с халогени, особено в реакции висока температура газове. Но експлозивност на тези продукции се допълва от факта, че много халогениран дават експлозивна смес с въздуха. По този начин, взривни границите на смеси с въздуха нагоре (об.):
CH3CI - 7,6 ÷ 19,0
C2H5CI - 3,8 ÷ 15,4
C2H4CI2 - 6,2 ÷ 16,0
С увеличаване на броя на халогенни атома в молекулата на съединение експлозията се намалява и дори метан тетрахлорид използва за гасене на пожари.
3. химия и теоретични основи на процеса на получаване на CFCs
Се наричат фреони или фреони ftorhlorproizvodnye метан и етан. Това - газообразни вещества или течност с ниска точка на кипене със слаб мирис, много малко токсични и напълно негорим. Такива свойства са осигурили тяхното широко използване като хладилни агенти в хладилни машини. Важен прилагане на CFC аерозолен спрей е някои вещества. Фреони са също междинни съединения в производството на флуо.
За фреони инсталирани съкратените наименования, съответстващи на техния химически състав, - .. фреон-12, фреон-114 и др последната цифра показва броя на атоми флуор, втората цифра, втората цифра отдясно е един повече от броя на водородните атоми, и първата отляво - за единица по-малко от броя на въглеродните атоми в молекулата. Така, в фреон-12 има два флуорни атома, и не е водород един въглероден атом, който дава формула CCI2F2. Фреон-113 се получава от етан и C2CI3F3 формула т. D.
Основни фреони са промишлено произведени чрез заместване на хлорни атоми на флуор в хлороформ, тетрахлорметан, тетра-, пента- - и хексахлоретан, и хлороформ. Показани са имената на някои Фреони и тяхната точка на кипене (или кондензация) при атмосферно налягане:
CHCI3 → → CHCI2F CHCIF2 → CHF3
Най-високата стойност в областта трябва фреон-12, фреон-22 и Фреон-113. Когато дълбоко охладен използване кипене фреон-13 и Фреон-23.
4. технологията на процеса на получаване на фреони
Като типичен пример разглежда производството на дифлуородихлорометан - фреон-12 от тетрахлорметан и безводен флуороводород в присъствието на антимонови халиди. Реакцията се провежда при 1000 ° С и 3 МРа; в този CCI4 налягане, CCI3F и HF са течни и да CCI2F2 отдестилира като се формира, като по този начин предотвратява получаването на значителни количества CCIF3.
Технологична схема на производство на CFC-12 е показан на фиг. 1. Въглероден тетрахлорид и течен флуороводород, предоставена от помпи 1 и 2 под налягане в реактор 3, където течната катализатор (смес от хлориди и флуориди три - и петвалентен антимон, разреден фуража реагент и nedoftorirovannym продукт). Към сместа се подава периодично на малки порции хлоро.
Реакторът се състои от стомана с апарат антикорозионни покрития оборудвана с парна риза, опаковани под обратен хладник колона, обратен хладник 4 и 5. Получената HCI извършва с пари на органични вещества и флуороводород. В колона 4 настъпва кипене пара и въглероден тетрахлорид и монофлуоротрихлорометан връща в реактора. За създаване на обратен хладник част от парата се кондензира в кондензатор 5 дифлуородихлорометан и се връща в обратен хладник в колона 4.
смес газ-пара напуска кондензатора 5 съдържа предимно хлороводород и дихлородифлуорометан с смес momnoftortrihlormetana, monohlortriftormetana и флуороводород. След намаляване на налягането до атмосферното в разширителен клапан 6 HF се отделя в кула 7 опаковани парчета калиев флуорид. Последният реагира с HF, образувайки KHF2, който може да се използва за получаване на флуор чрез електролиза. Диаграмата показва най-простият пречистване чрез абсорбиране на излишната вода в скрубера 8 и воден разтвор на основа в скрубер 9. Дехидратацията на останалата газ може да се извърши с концентрирана сярна киселина, циркулиращи в колоната 10.
За разделяне ftorhlorproizvodnyh използва ниска температура поправка. Двойки пресовани от компресор 13 до налягане от 1.0-1.2 МРа и солен разтвор се охлажда в хладилник 11 до минус 10 - минус 150 ° С. Полученият кондензат се изпраща към устройството за разделяне, състояща се от няколко дестилационни колони.
Светлинният фракция съдържа monohlortriftormetana (с малка смес дифлуородихлорометан), което е производство страничен продукт. Тежка остатък след дестилация съдържа монофлуоротрихлорометан връща в реактора. Целевата фракция на фреон-12 се получава като течност под налягане. За използване като хладилен агент е допълнително необходимо да се изсушава - лечение замразяване влага или твърди адсорбенти, като например зеолити.
Наскоро, фреони разработена и въведена в газова промишленост синтез на CCI4 и HF в psevdoozhennom слой на хетерогенен катализатор на основата на антимон в 4000C. Както хлориране процеси Обединените се предлага да се комбинират хлорирането на въглеводород (СН4, C2H6), заместването с хлор чрез HF. Реакцията се провежда чрез регулиране на температурата чрез рециклиране преобразувани недостатъчно флуорирани и хлорирани производни.
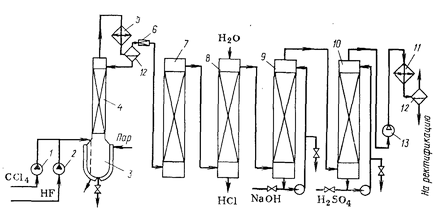
Фиг. Технологична схема 1 фреон-12
1.2. Помпи реактор 3., 4. кипене на обратен хладник колона 5. обратен кондензатор 6. дросел клапа. 7. кула почистване, 8, 9. скрубера 10 колона дренаж 11. Хладилник 12. сепаратор 13. Компресор
2. Chichibabin началото на органичната химия. Goskhimizdat М., 1963 - 922 стр.;
3. Лебедев и технология на органичен и нефтохимическата синтез. М. химия. 1988 - 592 стр.
4. Vishnjakova нефтохимическата синтез. М., 1973 - 448 стр.;
5. Yukelson органичен синтез. М. "Химия" 1968.