Електропроводимостта на електролитни разтвори
При липса на външно електрическо поле йони са в разтвор в непрекъснатата случаен термична предложение. При възникване на потенциална разлика, те придобиват директното движение от едно поле към другите, катиони и аниони се движат в противоположни посоки. По този начин, на електрически ток. За разлика от метали, които се характеризират с електронен механизъм на електрическата проводимост в електролитни разтвори ток се прехвърля от движението на йони. Ето защо, електролити, приписвани на проводниците от втория вид.
Количествените характеристики на способността на системата за провеждане на електрически ток - електрическа проводимост. Устройството на електрическата проводимост на електролитни разтвори е специфичната електропроводимост - реципрочната стойност на съпротивление:
. [Ома -1 m -1 = Виж m -1]
където г - съпротивление
;
R - общото съпротивление проводник, в омове;
л - дължина на проводника в метри;
и - проводник напречно сечение т2.
Специфична електрическа проводимост на разтвора на електролит - разтвор електропроводимостта на обема между две паралелни електроди с площ от 1 m 2 и на разстояние 1 m от друг.
Специфичната електропроводимостта зависи
- вискозитет и диелектрична константа на разтворителя;
- скоростта на движение йон, което зависи от големината на йонен заряд и радиуса с хидратиране.
Чрез увеличаване на проводимостта на концентрацията на електролита първоначално увеличава и след това намалява. Такава зависимост е характерна за двете силни и слаби електролити. Това се дължи на слаби електролити намаляване степента на дисоциация, и за силните - електростатично взаимодействие между йоните.
Заедно с проводимост използва в моларен електрохимията електропроводимост # 955; - електрическа проводимост, по броя на моловете на разтвореното вещество в 1 м 3 на разтвора:
където V - разреждане (обем на разтвора, в който електролитът съдържа 1 мол).
За практически единица изчисление може да се използва производни, например чрез експресиране на концентрация в мол / дм 3 моларен връзка между електрическата проводимост и се изразява с уравнението:
Моларен електропроводимостта на обема на електролитен разтвор равен на електрическата проводимост на разтвора на електролит, съдържащ 1 мол на разтвореното вещество, и се поставя между две паралелни електроди 1 метър площ 2. разстояние 1 m от друг.
Фиг. Curve I съответства на силен електролит, крива II - слаб електролит.
Моларен проводимост винаги намалява с увеличаване на концентрацията на електролита поради електростатично взаимодействие между йоните. Колкото повече йони в разтвор, по-кратък от разстоянието между йоните и силна взаимодействието така йони взаимодействат с друг, за да се движат. С увеличаване на моларни разреждане проводимост се увеличава, и при 0 ° С ® тенденция към гранична стойност # 955; ¥. (# 955; ¥ - ограничаване моларен електрическа проводимост). От изключително разреден разтвор взаимодействие между йони отсъства, можем да предположим, че всяка йон движи независимо от другите йони при максимална скорост.
В контекста на правото на ограничено разреждане на независим движение на йони - закона на Kohlrausch. при което ограничава моларен проводимост на електролитен разтвор равен на сумата на моларните проводимостта на катион и анион на безкрайно разреждане:
,
където - ограничаване на проводимост (подвижност), катион и анион.
Ion мобилност характеристика електрически количество, което прехвърля йон и определя абсолютната скорост на движение (т.е. скоростта на движение на електрическо поле на 1 V / m):
;
,
където F - Фарадей номер F = 96 480 С / мол;
. - абсолютната скорост на движение на катион и анион в разтвора дадена концентрация и в безкраен разреждане, съответно.
Абсолютната скоростта на йоните е най-(4 ¸ 8) 10 -8 m 2 / (В х с). Единствените изключения са йоните H + и OH -. абсолютната скорост на движение от които са много големи.
Абсолютната скоростта на катионите и анионите не са еднакви, делът на електроенергия извършва от отделни йони може да варира. За да се характеризира се използва количеството електроенергия извършва от този вид йонен транспорт номер. Транспорт брой - е съотношението на количеството електроенергия прехвърля този тип йони към общата сума на електроенергия на прехвърления електролитен разтвор. катион транспортни номера т + Т и аниони могат да експресират електрическа проводимост:
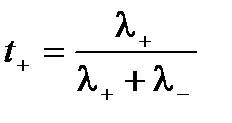
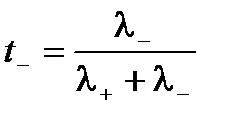
По този начин, броят на транспортния - е относителната мобилността на йоните. Сумата на катиони и аниони трансфер
.
Ефект на йон-йонна взаимодействие на електрическата проводимост на разтвора отразява съотношението на електропроводимостта ет:

Връзката може да бъде изразена чрез уравнението L от ет и степента на дисоциация на:
.
За разтвори на слаби електролити йон-йонни взаимодействия могат да бъдат пренебрегнати, след ет »1, тогава
което означава,
.
По този начин, чрез измерване на проводимостта на определена концентрация на разтвора може да се определи степента на дисоциация на електролита. стойност # 955; ¥ може да бъде изчислена по уравнението Kohlrausch въз основа на референтните данни или експериментално определена. За тази измерва електрическата проводимост на слабите електролитни разтвори на различни концентрации. В съответствие със закона на разреждане на Оствалд
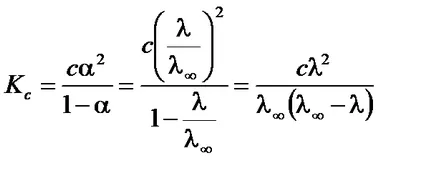
Уравненията на линейна форма, разделяне един в ляво и дясно части:
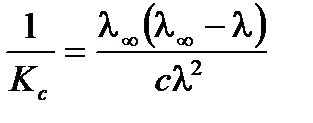
.
.
Получават уравнението на линеен тип. къде. , , , За да се определи # 955; ¥ Kc и нанасят в координатите. в съответствие с това. , ,
Слаба зависимостта на проводимост от концентрацията на разтвора на електролит може да бъде изразена чрез уравнението Ostwald. За слаба двоичен електролитен разтвор (а <<1) в соответствии с законом разбавления Оствальда получим:
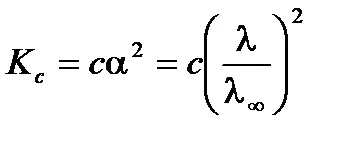
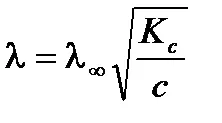
От уравнението следва, че моларното проводимост на слаб разтвор на електролит намалява с увеличаване на концентрацията.
За силни електролити # 945; ≈ 1. Тогава
;
,
Следователно, стойността на дадена концентрация разтвор може да се изчисли на електропроводимостта електрическата проводимост.
Зависимостта на моларното проводимост на електролитен разтвор от силна концентрация Onsager изразява чрез уравнение:
,
където А и В - теоретични коефициенти в зависимост от диелектрична константа, вискозитета на разтворител разтворител и температура.
Както се вижда от уравнение Onsager, с увеличаване на концентрацията на електролита електрическата проводимост на разтвора се понижава.
С повишаване на температурата на проводимостта на увеличенията на електролитен разтвор. Това се дължи на намаляване на вискозитета на разтвора с повишаване на температурата и увеличаване на скоростта на движение на йони, както и за слабите електролити увеличава като степента на дисоциация.