Ефект на катализатора върху скоростта на химични реакции
Вещества, които са включени в реакциите и увеличаване на скоростта му, останалите непроменен до края на реакцията, наречени катализатори.
Феноменът на промяна на скоростта на реакцията под действието на такива вещества, наречени катализа. Реакциите под влиянието на катализатори се наричат каталитични.
В повечето случаи, ефектът на катализатор се обяснява с факта, че тя намалява активиращата енергия на реакцията. В ката-рекуператори реакция присъствие минава през междинни етапи, различни от, без тези стъпки енергично разположение. С други думи, в присъствието на катализатор като други активирани комплекси, и тяхното образуване изисква по-малко енергия, отколкото за образуването на комплекси активират срещащи без катализатор. По този начин, енергията на активиране намалява рязко: някои молекули, чиято енергия е достатъчна за активна сблъсък сега са активни.
За редица реакции изследвани междинни съединения; Като правило, те представляват много активен нестабилни продукти.
Механизмът на катализаторите е свързано с намаляване на активиране на енергия поради образуването на междинни продукти. Катализ могат да бъдат представени, както следва:
където А. К - активирано междинно съединение.
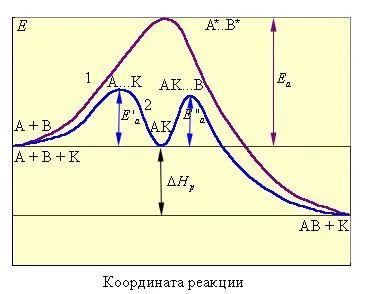
Фигура 13.5 - път Изображение некаталитичен реакция A + B → AB реакция (крива 1) и хомогенна каталитична реакция (крива 2).
В химическата промишленост катализатори се използват много широко. Под влияние на реакцията катализатори могат да изразят проверка ryatsya милион пъти или повече. В някои случаи под влияние на катализатори могат да се вълнува такива реакции, които без тях на практика се случи в тези условия.
Разграничаване между хомогенна и хетерогенна катализа.
В случай на хомогенна катализа, катализаторът и реагентите образуват единична фаза (газ или разтвор). В случай на хетерогенен катализатор, катализаторът е в системата като независим фаза.
Примери на хомогенна катализа:
1) окисление на SO2 + 1 / 2O2 = SO3 в присъствието на NO; NO лесно се окислява до NO2. и NO2 вече окислява SO2;
2) разлагане на водороден прекис във воден разтвор на вода и кислород: О 2 йони CR2 = 7. WO 2- 4. МоОз 4 2- катализират разграждането на водороден пероксид, форма с тях междинни съединения, които допълнително се разлагат с отделяне на кислород.
Хомогенна катализа се извършва чрез междинна реакция с катализатор, и резултатът е заместване на една реакция с висока енергия активиране на няколко, в която активация енергия ниска честота на по-горе:
CO + 1 / 2O2 = CO2 (катализатор - водна пара).
Широко използвани в химическата промишленост е хетерогенен катализатор. Повечето от продуктите, получени в момента тази индустрия се получава чрез хетерогенен катализатор. В хетерогенна реакция катализа се появява на повърхността на катализатора. От това следва, че активността на катализатора зависи от размера и свойствата на повърхността си. За да има голям ( "развита") на повърхността, катализаторът трябва да има пореста структура или да е в силно фрагментиран (силно диспергиран) състояние. В практиката, катализаторът обикновено се прилага към носител с пореста структура (пемза, азбест, и т.н.).
Както в случая на хомогенна катализа, хетерогенна реакция катализа настъпва чрез активни междинни съединения. Но тук, тези съединения представляват съединения с повърхността на реагентите катализатора. Преминавайки през серия от стъпки, включващи тези междинни съединения, реакцията завършва с образуването на крайните продукти, и полученият катализатор не се консумира.
Всички хетерогенни каталитични реакции включват етапа на адсорбция и десорбция.
Каталитичното действие на повърхността се намалява на два фактора: увеличение в концентрацията на интерфейса и активирането на молекулите на адсорбирани.
Примери на хетерогенен катализатор:
Една много важна роля играе катализа в биологичните системи. Повечето от химични реакции в храносмилателната система, кръв, и в животински и човешки клетки, са каталитична реакция. Катализаторите, посочени в този случай ензими представляват прости или сложни целия протеини. Например, слюнка съдържа птиалин ензим, който катализира превръщането на нишестето в захар. Един ензим, присъстващ в стомаха - пепсин - катализира разцепването на протеини. Човешкото тяло е около 30 000 различни ензими, всеки от които служи като ефективен катализатор за реакцията.
Селективността на действие на катализатора е, че реакционните продукти могат да бъдат различни в зависимост от това катализаторът ние използваме.
Много бавен поток от нежелани химични процеси в много случаи е възможно, чрез добавяне на инхибитори на реакционната среда (явлението "отрицателен катализа").
Page генерирана за: 0.005 сек.