Действие на алкални метали
01 февруари Fe 0 - 2Е Fe → Fe процес 2 окисляване 0 - редуктор
2 януари 2Н + + 2е → Н2 0 процеса на възстановяване Н + - окислител
Fe + 2Н + → Fe2 + + Н2
EMF = 0 - (-0.44) = 0.44 на
Концентрирана сярна киселина се разтваря металите, намиращи се в напрежения ред метал сребро (включително). Неразтворимите злато и платина елементи (Pt, Os, Ru, Ir, Rh, Pd).
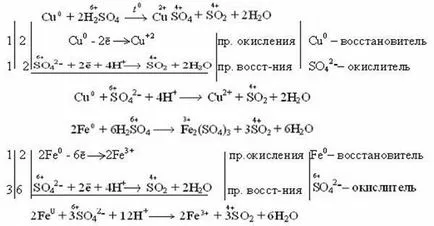
Окислителят в този случай, сярата е в състояние окисляване 6, които в зависимост от активността на метал и условията (киселина концентрация, температура) може да се намали до 4 сяра, 0, -2. Така, продуктите от възстановяването на сяра сярна киселина могат да бъдат
Например: неактивни и по-малко активни метали (Cu, Ag, Fe, Ni) намалява серни да сяра 6 4 (SO2). Реакцията протича чрез нагряване.
Както се вижда от реакции разредена сярна киселина за окисляване на желязото до 2, и се концентрира до 3.
По-активните метали се редуцират до 6 сяра свободна сяра (S 0) и сероводород (Н2 S), който има степен на окисление на сярата -2.
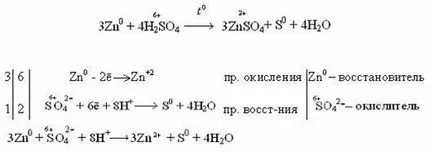
Действието на азотна киселина на метали
Азотна киселина, е силен окислител, действа за почти всички метали (с изключение Au, Pt, Ru, Rh, Ir, Os, Ta), превръщането им в нитрати, а някои - в оксиди (метали пасивация).
Особеността на действие на азотна киселина на металите е, че той окислява метали дори без отделянето на водород от разреден разтвор на киселина, за разлика от сярна киселина. намаляване на дълбочината на азот от азотната киселина зависи от концентрацията и активността на последните взаимодейства с метала. Колкото по-разредена киселина и по-активен метал, толкова по-голяма е възстановяването. Азот възстановени киселина
ÜRazberem някои примери на азотна киселина с метали.
Когато взаимодейства с концентрирана azotnoykisloty неактивни метали освободен NO2:
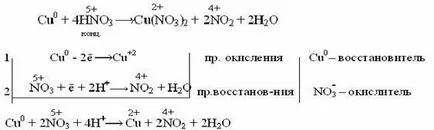
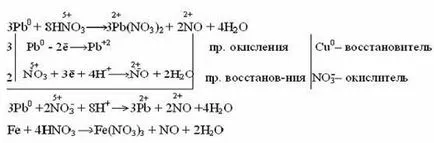
азотна киселина В разредена с по-малко активни и неактивни метали (Pb, Cu, Ni, Ag, Fe) образува NO:
Много разредена азотна киселина се редуцира до амоняк (NH3) чрез реакция с много активен метал, който образува в кисела среда амониев йон NH4 +:
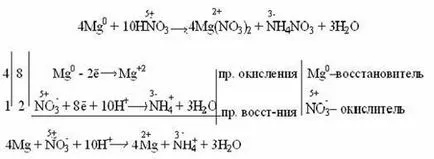
Концентрирана киселина passivates някои метали (Al, Cr, Fe), в резултат на покритие на метален оксид тънък филм:
Следователно, концентрирана азотна киселина се транспортират в алуминиеви съдове и се разрежда - резервоар на киселина устойчива стомана.
Метали да изместват взаимно от солеви разтвори. Възможността за такива реакции се определя чрез преминаване на позиция метал в електрохимичната серия: голяма изместват по-малко активни метали от разтвори на техните соли.