асиметричен въглероден
асиметричен въглероден атом (хирален въглерод) е въглероден атом, който е прикрепен към четири различни видове атоми или групи от атоми. Член Le Bel-Van't Hoff показва, че количеството на стереоизомери органични съединения се равнява 2n, където п е броя на асиметричните въглеродни атоми (освен ако има вътрешна равнина на симетрия). В резултат на едновременни съобщения Le Bel и Van't Hoff през 1874 г., че най-вероятно ориентацията на въглеродния атом, свързан към четири атома, насочено към височините на тетраедъра, и това обяснява всички познати явления докато молекулно асиметрия (което включва въглероден атом свързано с четири различни атоми). Познаването на броя на асиметричните въглеродни атоми, може да се изчисли максималния възможен брой от стереоизомери, за всяка дадена молекула, както следва:
Ако п - брой на асиметрични въглеродни атоми, максималният брой от изомери = 2n
Като пример, ябълчна киселина с 4 въглеродни атома, но само един от тях е асиметрична. Atom е асиметричен въглероден атом свързан с два въглеродни атома, кислороден атом и водороден атом (на фигурата по-долу третата отляво). Първоначално, може да представлява интерес да се мисли, че това атом е асиметричен, защото е свързан с два въглеродни атома, но тези два въглеродни атома са от своя страна, свързана с различни заместители, това го прави асиметричен въглероден атом:
Тетрози 2 асиметрични въглеродни атоми има 22 = 4 стереоизомери:
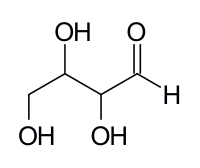
Aldopentoza 3 асиметрични въглеродни атоми е 23 = 8 стереоизомери:
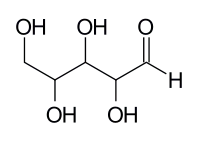
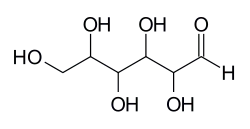
Aldogeksoza 4 асиметрични въглеродни атоми е 24 = 16 стереоизомери:
Четири групи от атоми, свързани с въглероден атом, могат да бъдат подредени в пространството по два различни начина, които са огледални образи един на друг и водят до така наречения отляво и изпълнения на една и съща молекула. Молекули, които не могат да бъдат наложени върху собствената си огледален образ хирални разглежда като огледален образ.