ароматни въглеводороди
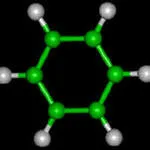
Ароматни въглеводороди (арената) - въглеводородна молекули които съдържат един или повече бензенови пръстени. Общата формула на ароматни въглеводороди - Cn H2N-6.
Най-простият представител на ароматен въглеводород е бензен - С6 H6
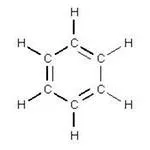
Според съвременните концепции на въглеродни атоми в бензен са в SP 2 хибридизация. Установено е, че всички електрони са включени в образуването на връзки между въглеродните атоми в бензен равномерно разпределени. Всеки въглероден атом е свързан към два съседни SP 2 с помощта на електрони и р-електрони. P-електронен облак форма насипни осмици разположени перпендикулярно на молекулно равнина и равномерно се припокриват един с друг и образуват една система π-електрон. Тази специална комбинация от шест И-връзки с един π- система, наречена ароматен връзка.
Имената произвеждат ароматни въглеводороди с думите "бензен" или "фенил", например метилбензен, фенилметан толуен.
Ако има 2 заместители в молекулата на бензен, те представляват "орто" (о-, 1,2) "т" (т, 1,3), "пара" (N, 1,4 -)
Методи за получаване на арени.
Предимно ароматни въглеводороди, получени от дестилация продукт на въглища и нефт. Синтетично произведени тях:
2. От ароматни киселини соли:
3. Чрез Friedel-Crafts реакция на бензен хомолози получава:
4. Реакционната Vyurtsa- Wilhelm Рудолф Fittig:
Химичните свойства на ароматни въглеводороди
1. водород присъединяване:
2. халогени за присъединяване:
3. Замяна на атом (или атоми) на водород халоген (и):
6. Алкилирането (Friedel-Crafts реакция):
7. окисление. Бензенът е устойчиви на окисление, хомолози на бензен, толуен силни окислители се окислява до бензоена киселина (К2 CR2 О7 КМПО4.):
Условия за ориентация, докато електрофилни реакции на заместване в бензен производни.
Еднакво електронна плътност в молекулата на бензен обикновено се разгражда с определени заместници. втори заместител се ръководи в определена позиция спрямо първото в електрофилни реакции на заместване (SE).
Заместителите (orientant) от първия вид са електрон и хранени отново въвеждане на заместители в орто и пара позиция спрямо себе си. Те включват: -N (CH3) 2, -NH2, -OH, -СН3. CI, Вг. и др.
Заместителите (orientant) от втория вид са електрон привличаща и повторно въвеждане на директни заместители в мета позиция по отношение на себе си. Orientant Това са: - NO2. -С ≡ N, - СОН, -СООН, - SO3 Н.
Това беше урок по химия 33 - ароматни въглеводороди. Бензен. Подготовка, Имоти