3 Химическа връзка
Химическа връзка - е взаимодействието между два атома, извършена в преразпределението на електроните на орбитите валентните, при което има стабилна осем или две електронна конфигурация на благороден газ близкия (октет или г) поради образуването на йони (V.Kossel) или образуването на електронни двойки споделени (T .Lyuis). Общата енергия на системата в същото време намалява.
3.1 Основни характеристики на химичната връзка
3.1.1 свързване енергия - изисква да пробие химични връзки във всички молекули, представляващи един мол вещество или енергия печалба по време на образуването на съединение индивидуално атома (ЕВ) енергия. Колкото по-висока енергия на химичната връзка, толкова самата връзка, толкова по-стабилен от молекулата.
Обикновено, свързващата енергия се измерва в килоджаули на мол, кДж / мол.
кДж / мол. За поливалентни съединения с връзки от същия тип на свързване енергия получи средната стойност, изчислена чрез разделяне на енергията на образуването на съединението от атомите на броя на връзки. Така, в разцепването на връзка Н-Н, прекарано 432.1 кДж / ∙ мола, и пулверизиране на метан CH4 - 1648 кДж / ∙ мол, в този случай, ЕО-H = 1648: 4 = 412 кДж.
Особено силно йонни и ковалентни връзки. енергия, която варира от десетки до стотици кДж / мол. метален връзка е обикновено малко по-слаби йонни и ковалентни връзки, но стойността на свързващата енергия на метали са близки до стойностите на енергията на йонни и ковалентни връзки. енергия водородна връзка е много малък и е обикновено стойност 20-40 кДж / мол, а енергията на ковалентни връзки, може да достигне няколко стотин килоджаули на мол, килоджаул / мол.
3.1.2 Дължината на комуникация LSV. Ако химично свързване възниква две припокриващи електронни облаци от атомите и разстоянието между ядрата на атомите става по-малко от сумата от разстоянията от ядрата на външните зони на най-голяма плътност на електрони в атома.
Дължината на свързването, равна на разстоянието между ядрата взаимодействащи атоми в съединението. Тя се измерва в пт, или ангстрьома А (1 А = 10 -8 cm). Това зависи от размера на електронен слой, и тяхната степен на припокриване. Има определено съотношение между дължината и свързващата енергия: с намаляваща дължина връзка обикновено увеличава свързващата енергия на молекулите и съответно устойчивостта към разпадане или изложени на други вещества.
3.1.3 полярност връзка се характеризира с йонен компонент, т.е. изместване на електронна двойка за по-електроотрицателна атом, образувайки по този начин дипол. Дипол - система от две равни, но противоположни заряди, които са на единица разстояние един от друг. Полярността на връзката може да бъде изразено от неговия диполен момент μ. равна на произведението от начално зареждане дипол, дължината μ = д ∙ л. момент дипол се измерва в Медальони на метър, CI ∙ m, или Debye, D.
1D ∙ = 0,333 10 -29 m ∙ Cl. Това е количеството вектор и е насочена по оста на дипол отрицателен заряд на положителна.
Полярността на молекулата като цяло се определя от разликата в electronegativities на атомите, образуващи геометрията две център връзка на молекулата, както и наличието на несподелени електронни двойки, като част от електронната плътност в молекулата не може да бъде локализирана в посока на връзки. То се изразява по отношение на нейната диполен момент, който е равен на вектора на сумата от диполни моменти от оковите на молекулата.
Ако се прави разлика диполни моменти (полярност) и връзката на цялата молекула. Например, за линейна молекула СО2 μ = 0 (въпреки че всеки от полярността и молекулата като цяло неполярен, тъй като молекулата е G = С = О е линейна и диполни моменти от С = О неутрализират взаимно), но Н2 О ц ≠ 0. присъствието на диполен момент в молекулата на водата смисъл, че той не е линеен, т.е.. напр. свързване на О-Н под ъгъл не е равна на 180 °.
3.1.4 пространствената структура на молекули - е формата и разположението в пространството на електрона облаците, като се вземат предвид естеството на химичната връзка.
В съединенията, съдържащи повече от два атома, важна характеристика е ъгълът на валентността, образуван чрез химични връзки в молекулата и който отразява неговата геометрия.
3.1.5 Процедура за комуникация (съобщение множество) - е броят на двойките социализирани разделен между два свързани атоми. Колкото по-висока от порядъка на връзка, толкова по-силно свързани помежду си атоми и по-късия самата връзка. Редът на връзките по-горе три не е намерен. Например, редът на комуникация в Н2 молекули. O2 и N2 е равно на 1, 2 и 3, съответно, тъй като в тези случаи комуникация е образувана от препокриването на една, две или три двойки електрони облаци.
3.1.6 насищане комуникация - способността на атом до получаване на определен брой химични връзки. Някои видове химически saturability взаимодействие не са, т.е. частици могат да образуват различен брой връзки с нейните съседи. Това свойство е присъщо на йонна връзка.
3.1.7 метода на припокриване на електронните облаци. Чрез припокриването на електрони облаци са разделени в комуникация σ - връзка и π - връзка (Фигура 4).
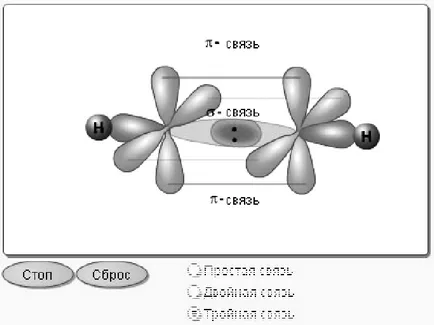
Фигура 4 - схема на σ - и π - връзка
σ - връзка се формира поради припокриването на електрона облаците на линията, свързваща между активните центрове на атомите. Той може, например, между две облаци S-, р- между две облаци между S- и р-облаци или между S- и d- облаци. π - връзка се формира поради припокриването на електрони облаци от двете страни на линията, свързваща центровете на взаимодействащи атоми (поради страничното припокриване на електрони облаци). Тя се формира в значителна припокриващи р орбити. σ - връзка е по-силна от П - връзка, тъй като осигурява по-пълно припокриване и затова се нуждае от почивка, за да прекарват повече енергия.
Теории, обясняващи химичната връзка
Понастоящем се използват две теории: метода на валентните връзки (МВС) и метода на молекулни орбитали (IMO).
3.2.1 Метод на теория валентна връзка се нарича също локализирани електронни двойки, в метод се основава на предположението, че образуването на атомите на молекулите запазят атомни орбитали, но за увеличаване на плътността на електрони (общата електронна двойка), който принадлежи към двата атома. За разлика от ММО, която е просто химична връзка може да е двойна и мулти-център, в МВС е винаги две електрон две център и да бъде сигурен.
Имайте предвид, че електроните в съответствие принцип Pauli с трябва да са противоположно насочени назад, т.е. в MVS всички завъртания са сдвоени и всички молекули трябва да бъде диамагнитната (като магнитните свойства се дължат на присъствието на свободни електрони). Следователно принцип MFR може да обясни магнитните свойства на молекулите.
3.2.2 Метод молекулни орбитали въз основа на факта, че всеки молекулно орбитален представени като алгебрична сума (линейна комбинация) на атомна орбитала. Това означава, че образуването на молекули на атомна орбитала като такива изчезват и на тяхно място са нови молекулни орбитали. Освен това, броят на молекулни орбитали е сумата на първоначалния атомна, но част от молекулните орбитите на ниска енергия (свързване МО), и част от енергията горе (дезинтегриращи МО) от първоначалната атомна.
Например, в молекулата на водород в образуването на MO могат да участват само 1S атомна орбитала на два атома водород, които дават две МО. Тъй като зърната в взаимодейства водородни атоми са същите, след това приносът на атомна орбитала е същото. И тъй като водород молекула взаимодействие е възможно само чрез молекулното ос, всяка от МО може да бъде Предишен като комуникационната сигма и сигма * и име съответно свързване (σ свързване) и antibonding (σ *) молекулни орбитали.
Две Electron Transfer MO σ комуникационна система улеснява намаляване на енергията; Тази енергия печалба е свързващата енергия между водородни атоми в молекулата Н-Н. Това означава, че електроните заселват свързване MO Св σ стабилизира системата и уреждането на разпадащи - това дестабилизира.
Съгласно реда на метод МО (множество) на полу svyazinopredelyaetsya svyazyvayuschihNsvi razryhlyayuschihNrazelektronov
Колкото по множеството съобщения, особено силна връзка в молекулата. В нула множество се образува молекула връзка.
Помислете за някои случаи на молекулярната структура на ММО.
Н2 молекула, образувана от две H атома, атомната валентност на който е показан по един електрон да 1S- подслой. В това, което е необходимо, че електроните имат противоположни завъртания. Това показва структурата на Н2 молекули на следващата схема енергия (Фигура 5). При попълването на формуляра тази схема има предвид принципите на запълване на електронните орбити на (принципа на Паули, принцип Hund е, на принципа на минимална енергия).
Фигура 7 - схема на енергия на молекулите НЕ2
В този случай връзката ще бъде равна на множество п = (2-2) / 2 = 0, т.е. комуникация не се извършва, тъй като няма обща електронна двойка и не печалба в енергия. Една молекула не се произвежда при тези условия.
За водород и хелий са компоненти с по-сложна структура на електрони обвивка, следователно, молекулите, продуцирани от тези вещества ще имат съответната структура.
Да разгледаме този пример в молекулата 2 (Фигура 8). Тя се формира от два кислородни атоми с AVZ 2s 2 2p 4. Тъй като S- орбитите имат по-малко енергия, отколкото стр. на енергия диаграмата, те ще бъдат поставени по-долу. Моля, имайте предвид, че отново валентните електрони от различни атоми имат антипарапелни завъртания. Тъй като всеки атом осигурява един S- орбитални и три р орбитали, общият брой на молекулни орбитали е равно на осем. От двете атомна орбитала S- образувани две молекулни: σs - свързване и σs - дезинтегриращи (от припокриване на електрони облаци настъпва на линията, свързваща центровете на атоми).
От шест р орбитите образуват три свързване и три antibonding орбити. Поради факта, че една двойка електрони облаци припокриват по линията, свързваща центровете на атомите, са оформени между тях и свързване σr- σr- antibonding молекулни орбитали. Между останалите две двойки р орбитали ще бъде странично припокриване, така образувани две r- свързване орбитали, равни на мощността и два r- разграждане, точно същата енергия. В σr енергийната диаграма - лепене на орбитална намира под r- задължителен, тъй като образуването на σ- връзка се разпределя по-голяма мощност, като по този начин самата връзка ще има по-малко акумулирана енергия. Пълнене диаграма електрони (електрони 12 от два атома) протича с увеличаване на молекулната орбитала на енергия (нагоре). На antibonding орбитални двата електрона са на различни места, както в този случай, общото въртене на системата е минимизиран. Разнообразието на комуникация в този случай ще бъде равна на п = (8-4) / 2 = 2, т.е. връзка и от две двойки електрони.
