Валентност на различните окисление, каква е разликата
Валенцията и окисление - понятието, често се използва в неорганична химия. В много химически съединения валентността стойност и степента на окисление на елемента са същите, поради тази причина, учащите често объркване. Тези концепции имат нещо общо помежду си, но разликите са по-значими. За да се разбере каква е разликата между тези две понятия, е необходимо да се знае повече за тях.
Данни за степента на окисление
Степента на окисление - спомагателен стойност дължи на елемент атом, химически или група от атоми, която показва как разпределени споделен двойка електрони между съдействащите елементи.
Този помощен стойност, която няма самия физически смисъл. Същността му е достатъчно просто да се обясни с примери:
Годни за консумация сол NaCl молекула се състои от два атома, - хлорен атом и натриев атом. Връзката между тези атоми йон. В най Натриев валентност електрон ниво 1, това означава хлорен атом, общ електронна двойка. От тези два елемента по електроотрицателна хлорни (има свойството да се електронни двойки MIX), единствената обща двойка електрони измести към него. В съединението на елемент с по-високи elektrotritsatelnostyu има отрицателно окислено състояние по-малко електроотрицателна съответно положителен и неговата стойност е равен на броя на електрони споделени двойки. За молекула NaCl степента на окисление на натриев хлорид и ще изглежда по следния начин:
Хлоро, с офсет към нея електронна двойка, сега се счита като анион, т.е. атом, прикрепен към себе си допълнително електрони и натриев - като катион, т.е. атом електрон отдаваща. Въпреки това, по време на запис на степента на окисление на първо място там е знак, а вторият цифровата стойност, докато записвате йонната такса - напротив.
Окислението може да се определи като броя на електроните, които положителния йон не е достатъчно, за да електрически неутрални атоми или които трябва да отнеме от отрицателен йон за окисляване атома. В този пример е очевидно, че положителния йон на натриев чрез изместване на електрон двойка електрон липсва, докато хлорен йон един електрон излишък.
Обикновено окисляване степен (степен) материал, независимо от неговите физични и химични свойства, е нула. O2 молекула. например, се състои от два кислородни атома. Те имат същите стойности електроотрицателност, защото общите електроните не се движат и да е от тях. Следователно, електронната двойка е строго между атоми, тъй като степента на окисление ще бъде нула.
може да бъде трудно за някои от молекулите определи къде електрони се движат, особено ако елементите в него три или повече. За да се изчисли степента на окисление на тези молекули, е необходимо да се използват няколко прости правила:
- водороден атом е почти винаги има постоянна окисление 1 ..
- За кислород, тази цифра е -2. Изключения от това правило са само флуорни оксиди
Тъй като флуор - елемент с висока електроотрицателност, защото тя винаги се движи към себе си взаимодействат електрони. Според международните правила, член elektrootritsaelnosti-малка стойност е написано на първо място, тъй като в тези оксиди на кислород, на първо място.
- Ако добавите всички степени на окисление на молекулата, получавате нула.
- За типични метални атоми положителен окисление.
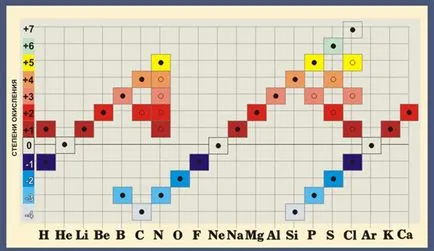
При изчисляване на степента на окисление трябва да се забравя, че максималната степен на окисление на елемента е равен на броя на неговата група, а минималната - номер на групата минус 8. хлор максималната възможна стойност на окисляване състояние 7, тъй като е в 7-та група и минимум = 7-8 -1.
Обща информация за валентност
Валентността - броят на ковалентни връзки, които могат да образуват елемент в различни съединения.
За разлика от състоянието на оксидация, концепцията за валентност има реален физически смисъл.
Най-висок ръст се равнява на валентността на номера на групата в периодичната таблица. Сяра S се намира във втората група, т.е. своята максимална валентността 6. Но той може да бъде 2 (Н2 S) или 4 (SO2).
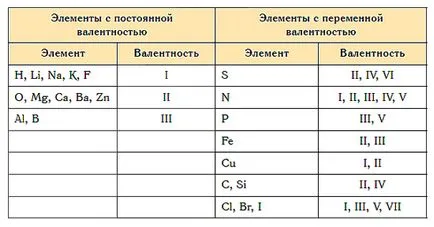
Почти всички елементи, характерни за променлива валентност. Все пак, има атоми, който тази стойност е постоянна. Те включват алкални метали, сребро, водород (им валентността винаги равен на 1), цинк (валентност винаги 2), лантан (валентността е 3).
Какво е общото между валентност и степен на окисление
- Да се идентифицират и един и другите стойности са използвани положителни числа, които са написани върху елемент латински символи.
- Най-високата валентност като най-високата окисление, да съвпада с номера на члена на групата.
- степента на окисление на всеки елемент в комплексното съединение съвпада с цифровата стойност на една от валентността на показатели. Например, хлор в 7-та група може да има валентност от 1, 3, 4, 5, 6, или 7, тогава е възможно окислението ± 1 + 3 + 4 + 5, + 6 + 7.
Основните разлики между тези понятия
- В понятието "валентност" физически смисъл, и степента на окисление - помощен план няма реална физически смисъл.
- Окислението може да бъде нула, е по-голяма или по-малка от нула. Валенцията е строго по-голямо от нула.
- Валенцията показва броя на ковалентни връзки, и степента на окисление - разпределението на електрони в съединението.