Структурата на водните молекули - Хидрогеология
Вода - един от най-забележителните вещества, познати на човека. Тя - на естествено вещество намира в големи количества в три състояния: твърдо, течно и газообразно състояние. От всички общи течна вода - най-течност гъвкав разтворител с максимални стойности на повърхностното напрежение, диелектрична константа, и висока температура на изпарение (след амоняк) на топлина на стапяне. За разлика от много вещества, вода, замразяване при ниско налягане, се разширява.
Тези специфични свойства на водата са свързани с специална структура на молекулите. Химична формула Н2 0 вода привидно проста. вода молекулни водородни атоми на ядрото са разположени асиметрично по отношение на ядрото на кислороден атом и електрони. Ако кислородният атом е в центъра на тетраедър, масовите центровете на два водородни атоми са в ъглите на тетраедър, и такси центровете на два електронни двойки заемат две други ъгъл (фиг. 3.1). По този начин, четири електрони са разположени на възможно най-голямо разстояние както от кислороден атом на ядрото, и ядрата на водородните атоми на които са изготвени ядро кислороден атом. Други шест водни молекули електрони са подредени така, четири електрони са в състояние да предоставят химична връзка между ядрата на кислород и водородни атоми, а другите две са разположени в близост до ядрото на кислородния атом.
Асиметричното подреждането на атомите на молекулата на водата предизвиква неравномерно разпределение на електрически заряди в него, като полярна молекула вода. Такава структура на молекулата на водата причинява водни молекули привличането помежду си в резултат на образуването на водородни връзки между тях. Местоположение водородните и кислородни атоми във водните молекули образуват агрегати е подобен на подреждането на силициеви и кислородни атоми в кварц. Това се отнася до лед и най-малко една течна водна молекула агрегати, които са винаги в етапа на преразпределение. При охлаждане, водните молекули са групирани в своите агрегати, които постепенно се увеличава и да станат по-устойчиви, тъй като се доближава до температура от 4 ° С, когато водата достигне своята максимална плътност. При тази температура, водата все още има твърда структура, и заедно с неговите дълговерижни молекули, има голям брой индивидуални водни молекули. С допълнителни охлаждащи вериги вода молекули растат чрез прибавяне към него на свободни молекули, при което плътността на вода намалява. Когато водата се превръща в лед, всички молекули са повече или по-малко твърда структура под формата на отделни затворени вериги образуващи кристали.
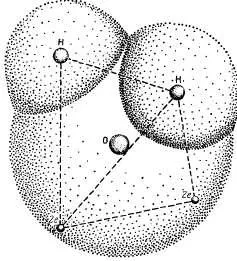
Фиг. 3.1. Структурата на водната молекула.
Взаимното проникване на водородните и кислородни атоми. Ядрата на два водородни атома и две двойки електрони са в ъглите на тетраедър: в центъра на ядрото кислороден атом.
Високите стойности на повърхностното напрежение и топлина на изпарение на вода се дължи на факта, че водните молекули са разделени от групата на молекули изисква относително голям разход на енергия. Желанието на водни молекули за установяване на водородно свързване и полярност обясни необичайно висока разтворимост във вода. Някои съединения, такива като захари и алкохоли, се запазват в разтвора поради водородни връзки. Съединения, които имат висока степен на йонизация на входа, като натриев хлорид, се запазват в разтвора се дължи на факта, че йоните се неутрализира чрез противоположно заредени групи ориентирани водни молекули.
Относителното изобилие и полуживот на изотопи на водород и кислород