Структурата на скелетните мускули
Структурата на скелетните мускули. хистология
Образуване на скелетни мускулни влакна с - много дълъг (30 cm) диаметър цилиндрични многоядрени клетки 10 - 100 микрона, образуващи връзки. Многоядрените се случва по време на ембрионалното период в резултат на сливане на мононуклеарни мио-бласти (мускулна прогениторни клетки). Овални ядра обикновено са разположени по периферията на влакното при клетъчната мембрана.
Знаейки това специално подреждане ядра полезно, когато е необходимо да се направи разграничение на скелетния мускул на сърдечната и гладка мускулатура, като в последните две ядра са разположени в централната клетка.
диаметър Различията скелетните мускулни влакна зависят от такива фактори, като специално мускул, възраст, пол, хранителен статус и физическата годност на лицето. Добре известно е, че упражненията се увеличава мускулите и намаляване на телесните мазнини. Така се получава увеличение на мускулната тъкан маса причинено изразено увеличение на диаметъра на всеки от мускулните влакна и влакна, които са нови влакна с.
Този процес се характеризира с увеличаване на клетъчния обем. известен като хипертрофия (гръцки хипер - излишък + trophe - хранене.); растеж на тъкан чрез увеличаване на броя на клетките, наречени "хиперплазия" (гръцки. хипер- излишък + образуване plasis-). Хиперплазия не се развива всяка скелетна или в сърдечна мускулна тъкан, но се среща в мускулната тъкан гладка, клетките на които не са загубили способността им да разделят чрез митоза. Хиперплазия често се развива в органи като матката, където по време на бременността се проявява като хиперплазия и хипертрофия.
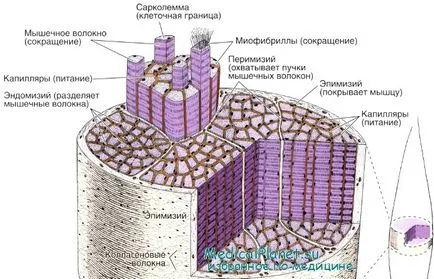
Организация - структура на скелетната мускулатура
Големи групи от влакна. които образуват различни видове мускули, без да са на случаен принцип, и са разположени по равномерен греди. Всички мускулна обгражда външната обвивка на плътна фиброзна съединителна тъкан - epimizy (гръцки епи -. Горна + ММС - мускул).
От epimiziya в мускулите отклони тънък слой съединителна тъкан, покриваща снопчета от влакна вътре в мускул. Съединителната тъкан околната всяка връзка на мускулните влакна, известни като perimysium (гръцки периоперативна около + ММС -. Мускул). Около всеки мускулно влакно е тънък слой заобикалящата съединителна тъкан - endomysium (Gk endon -. В + ММС - мускул), състоящ се главно от базалния слой и ретикуларни влакна.
Един от най-важните функции на съединителната тъкан в myshtsahyavlyaetsya механично предаване на сили, които се образуват в резултат на свиване на мускулните влакна, като в повечето случаи отделните мускулни влакна не се простират от единия до другия край мускулите.
Кръвоносните съдове навлизат мускулните слоеве, съставени от съединителната тъкан и образуват богата капилярната мрежа, която се намира между мускулни влакна и успоредно на тях. Капиляри е от непрекъснат тип; в съединителната тъкан и открити и лимфните.
Някои мускули са конусообразно заострени по ръбовете, където образува връзка с мускулно-сухожилие. Под електронен микроскоп, се вижда, че в този преход зона сухожилие колагенови влакна поставени в комплекса гънки plasmolemma мускулни влакна.
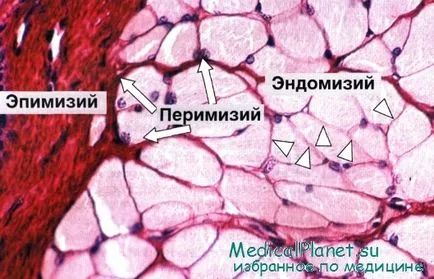
Организация - структура на скелетни мускулни влакна
Светлинна микроскопия на надлъжни разрези на мускулните влакна се вижда напречно набраздени-ност, причинена от редуващи се светли и тъмни ивици - дискове. Тъмните колела - A-колела (анизотропни) се наричат така, защото те имат двойното лъчепречупване в поляризирана светлина; леки джанти - I-дискове (изотропни) не променят посоката на поляризирана светлина. Под електронен микроскоп показва, че всеки I-диск се намали наполовина тъмно напречна линия, която е известна като Z-линия (telofragma).
Най-малката единица на периодичност на апарата за свиване е саркомера (Gk. Sarkos- месо + tege- част), която се намира между две съседни Z-линии. В покой мускулна дължина е 2,5 микрона.
Sarcoplasm мускулните влакна съдържа дълъг цилиндричен нишка с диаметър 1-2 mkm- миофибрили, които са разположени в него под формата на греди. Миофибрили успоредно на надлъжната ос на мускулните влакна и се състоят от вериги, свързани в техните краища саркомери. Саркомери съседни миофибрили са разположени така, че техните странични граници съвпадат - това причинява напречни бразди характерни за цялата на мускулните влакна.
Electron микроскопски изследвания са показали, че структурата на саркомера се определя главно от наличието на два вида влакна (дебели и тънки), които са разположени по симетричен начин, успоредна на надлъжната ос на миофибрили. Дължината на дебелите влакна е 1.6 цт, широчината (дебелината) - 15 пМ; те са в А-диск, който заема централната част на саркомера. Тънки нишки преминават между дебелите влакна, разположена паралелно към него; в единия край, те са прикрепени към Z-линия. Дължината на тънки влакна е 1.0 цт, широчината (дебелината) - 8 нм.
В резултат на тази конструкция I-диск се състои от парчета от тънки нишки, които не се припокриват с дебелите влакна. Дебел дискове за предпочитане са образувани от влакна, в допълнение към който те са призовава за дебелина част на тънки нишки влакна. В подробно проучване диск в нейния център е открит лек зона - H-бар, което съответства на област, състояща се от само части от прът миозинови молекули.
Н-лента разполовени линия М-половината (mesophragma), който е частта, където страничните връзки, образувани между съседни дебели нишки. Основният протеин на М-линия е креатин киназа. Този ензим катализира трансфера на фосфатна група от фосфокреатин (форма на групи високо енергийни фосфатни съхранение) на ADP, при което се образува АТР необходимо за мускулна контракция.
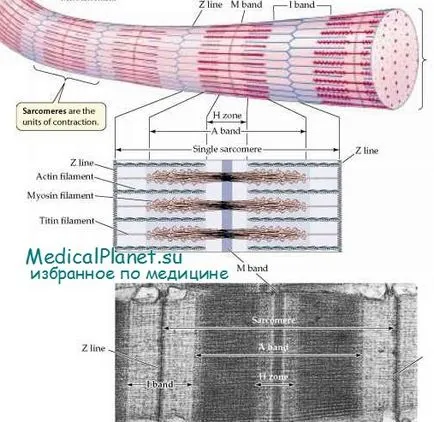
Дебелите и тънки нишки се припокриват на разстояние в рамките на А-диск. Следователно, в разрез напречно на припокриване нишки може да се види, че всяка нишка дебелина заобиколен от шест тънки нишки, разположени във формата на шестоъгълник.
Влакната в набраздения мускул съдържат няколко протеини; четири основни протеини включват актин, тропомиозина, тропонин и миозин. Тънките нишки са съставени от първите три протеини, като нишките на гъстата част главно миозин. Заедно с миозиновите и актиновите представлява 55% от общото съдържание на белтък в набразден мускул.
Актинът възниква като дълги мустаци (нишковидни) полимери (F-актин), който се състои от две прежди с кълбовидни мономери (G-актин) диаметър 5.6 пМ, усукани около един на друг, за да образуват двойна спирала. G-актин молекули притежават структурна асиметрия. При полимеризацията на молекули G-актин за образуване на F-актин, те vayutsya комуникация един с друг чрез ти NY 'края на върха ", формиращи нишки с ясно изразена полярност.
Всеки мономер съдържа G актин свързващ сайт на миозин. Актин нишки, които са закотвени в Z-линията и разположени перпендикулярно на него, имат противоположна полярност от двете страни на линията. Предполага се, че актинови филаменти, определени в тази област чрез използване на а-актин протеин, който е основният компонент на Z-линия. Смята се, че а-актин и десмин (междинно съединение нишка протеин) се свързват заедно съседни саркомери, като по този начин държи миовлакната в правилната позиция.
Тропомиозина - дълги, тънки молекула около 40 нм дължина, тя съдържа две полипептидни вериги. Тези молекули са свързани главата до опашката, формиращи нишки, които се намират в горната част на АКТИ-нов субединици по външните ръбове на вдлъбнатините между двете усукани актинови филаменти.
Troponin е комплекс от три субединици: TnT, който е здраво прикрепен към тропомиозина, TnC, който се свързва калциеви йони и TnI, който инхибира взаимодействието между актин и миозин. Troponin комплекс прикрепен към специфично място на всяка молекула на тропомиозина.
Тънките нишки всяка тропомиозина молекула обхваща седем молекули на G-актин и тропонин комплекс е един свързан с неговата повърхност.
Миозин - много по-голям комплекс (-500 кДалтона молекулно тегло), които могат да бъдат разделени в две идентични тежки вериги и две двойки леки вериги. Миозин тежка верига - тънки, пръчковидни молекули (дължина от 150 пМ и 2.3 пМ дебелина), който усукани двойки. Малък сферична (кълбовидни) издатина в единия край на всяка тежка вериги образуват главата, които съдържат АТР свързващите места и притежават способността да ензимна хидролиза на АТР (ATPase активност) и свързване с актин.
четири леки вериги, свързани към главата. Всеки дебели влакна, образувани от няколко стотици миозинови молекули, и техните пръчковидни части взаимно се припокриват и кълбовидни главата обърна към един от краищата.
Анализът на тънки секции от набразден мускул показва наличието на напречни мостове между дебели и тънки нишки. Тези мостове са, както се оказа, образуван от главата на молекулата на миозин и кратка секция на своя отдел прът участва в превръщането на химическа енергия в механична енергия.