Сравнение на свойствата на алдехиди и кетони
Както алдехиди и кетони могат да се прикрепят водород, циановодородна киселина, органомагнезиеви съединения, натриев хидросулфит. От кетони с натриев хидросулфит реагира само тези, които съдържат метилови или метиленови групи на два непосредствено към карбонила. Тъй като хидроксиламин, хидразин и производните му алдехиди и кетони взаимодействат за образуване на оксими, хидразони и фенилхидразони т. Г. Действието на фосфорни халогениди и сяра кислороден атом в молекулите на алдехиди и кетони, заместени с два халогенни атома.
Въпреки това, съществуват значителни различия между алдехиди и кетони. По този начин, за разлика от кетони, алдехиди не оцветяват с киселина фуксин разтвор се безцветни, не се кондензира под действието на основи при меки условия, които не дават ацетали с алкохоли, не дават реакция на сребро огледало.
Кетони окислен по-трудно от алдехиди, при което настъпва окисляване при скъсване на въглерод-въглеродна връзка; кетони трудно да се появят и кондензационна реакция; кетони дават цветна реакция с натриев нитропрусид.
Концепцията на ненаситени алдехиди и кетони
От този клас състави от специален интерес # 945;, # 946; -nepredelnye оксо съединения, съдържащи конюгирани система от връзки и кетен.
Ако въглерод-въглеродна връзка двойна се отделя от карбонилната група на повече от един С-С връзка, молекулата съдържа две независими групи, малко влияние от друг.
присъединяване към # 945;, # 946; -nepredelnym връзка се появява най-често в позицията на 1,4-конюгиран система. Трябва да се има предвид, че максималната плътност на електрони е по-електроотрицателен атом кислород, който определя процедурата за присъединяване.
Ketenes - оригинален съединение структурно наподобяващ ненаситени кетони и Allenes.
Кетек - първият от серия от ketenes. А газ с остра миризма. В големи количества, получени чрез пиролиза на ацетон:
Кетек не проявява обичайните свойства на кетони - не дава на оксим, Фенилхидразон, се различава голяма склонност за реакции на присъединяване. Той образува димер при съхранение.
Характеристики на синтез и химични свойства на хинони
Quinones - специфичен клас циклични ненаситени карбонилни съединения, имащи конюгиран система връзка.
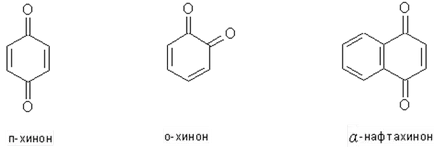
Quinones лесно се образуват чрез окисление на двувалентни феноли, съответната структура. (Вж. Окислението на феноли).
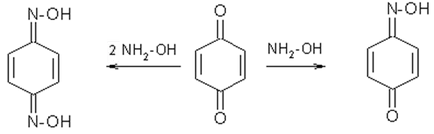
1. Quinones са силно реактивни вещества, намаляването на лесно се превръща обратно в двуатомни феноли

2. хинони с хидроксиламин хидрохлорид, за да образуват моно- и диоксимите:
3. В повечето реакции на хинони се държат като # 945, # 946; -nepredelnye кетони свързани различни реагенти (халогениди, амини, алкохоли, органични киселини и т.н.).
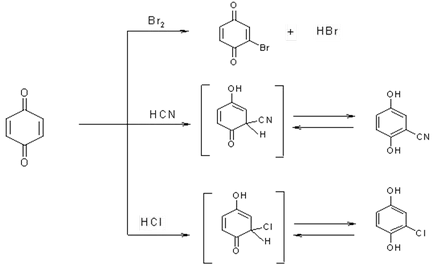
4. диенофила, хинони реагират диен синтез:
задача за самооценка
1. наименование на следните съединения от вас известни номенклатури:
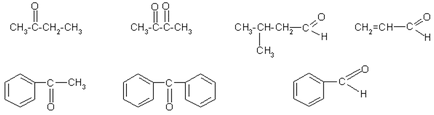
2. Добави структурните формули на следните съединения: ацетон, # 946; -hlormaslyany алдехид оксим циклопентанон; dimethylpropanal; пропанон хидразон; 4-formiltsiklogeksanon.
3. Получаване на ацеталдехид: от алкохол, от киселината на digalogenoproizvodnogo от алкин.
4. Добави всички видове реакции на нуклеофилно присъединяване към карбонила от примера на пропанал.
5. реакции запис кондензационни които са характерни за алифатни алдехиди (бутанал) и ароматен алдехид (п-толуалдехид).
6. Описание на кето-енол тавтомерия хлороглуцинол и неговите причинява.
6.5. Един и многовалентни карбонови киселини и техните производни: определение, изомерия, номенклатура
Органичният карбоксилна киселина се характеризира с наличието на карбоксилните групи # 9472; СООН. По броя на тези групи се отличават моно-, ди- и многовалентни киселини като цяло. Органичните киселини могат да бъдат алифатни (наситени и ненаситени), алициклична, ароматна.
Номенклатура и изомерия
Изомерия карбоксилна киселина радикал дефинирана структура, свързан към карбоксилната група.
Според IUPAC номенклатура киселина наречен съответната затваряне с добавка на въглеводороди и думи -ovaya киселина верига, където номерирането започва с въглеродния атом на карбоксилната група. Въпреки това, в повечето случаи, се използва често срещани имена.

Понякога в съставянето рационални имена киселини с въглероден разклонена верига, те се считат като производни на атоми на оцетната киселина в молекулата, където водородните атоми на метиловата група е заместен с радикали като например:

1. окисляването на органични съединения (въглеводороди, алкохоли, алдехиди, кетони):
2. Хидролизата на нитрила
3. Действието на въглероден диоксид на органометални съединения:
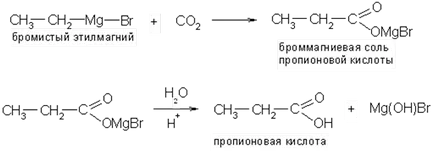
4. оксо. Реакцията на олефини с въглероден монооксид (II) и пара в присъствието на катализатори (никелов тетракарбонил, фосфорна киселина и т.н.) При температура 300-400 0 ° С и налягане от 2-5 # 8729, 10 7 Ра дава смес от нормална или разклонена верига киселини:
5. хидролиза trigalogenoproizvodnyh съдържащ халоген при един въглероден атом:
6. ароматни киселини могат да бъдат получени чрез окисление на бензол хомолози:
7. Освен това, ароматна карбоксилна киселина могат да се получат:
а) кондензиране ароматни формиати и сулфати с цианиди
б) взаимодействие на ароматни съединения с халогенни производни на карбонова киселина:

В зависимост от структурата на карбоксилна киселина са течности или твърди вещества. Намаляването на продължителността на въглеродния скелет или появата на допълнителни карбоксилни групи увеличи разтворимостта във вода. Физични свойства, влияещи киселини асоцииране на молекули чрез образуване на водородни връзки. Киселините за получаване на по-силни водородни връзки в алкохоли поради О # 9472; Н тях до голяма степен поляризирана. В твърдо вещество, течност и дори до известна степен в състояние на пара съществува карбоксилни киселини като димери:
Ароматни киселини вари в малко по-високо и се топят при по-високи температури от мастните киселини със същия брой въглеродни атоми. Водните разтвори на ароматни монокарбоксилни киселини показват по-висока степен на дисоциация от мастни киселини: бензоена киселина дисоциационна константа от 6.6 # 8729; 10 -5. оцетна киселина 1.75 # 8729; 10 -5.
Киселинният характер на карбоксилни киселини се произнася. Това се дължи на взаимното влияние на атомите в карбоксилната група: в това, плътността на електрони е изместен към най-електрон-атом на кислород

Това отслабва връзката между кислород и водород и улесняване отделянето на водород йон, т.е. киселина дисоциация.
Появата на ниска електронна плътност (# 948 +) на централния въглероден атом от карбоксилната група също води до свиване # 963, електрони съседен въглерод-въглеродна връзка с карбоксилната група и появата на ниска гъстота електрон (# 948 +) в # 945 въглероден атом киселина.
Промяната на електронната плътност в молекула недисоциирана карбоксилна киселина понижава плътността електрон на кислородния атом на хидроксилната група и карбонилната група на това се увеличава. Тази промяна е повече увеличава в киселинен анион.
В резултат на промяната е пълна изравняване на таксите в аниона, заглавие mesomerism karboksilaniona на. Привеждане електронна плътност води до печалба в енергетиката и в продължение на много реакции, е движещата сила, която се нарича енергия резонанс.
Наличието на електрофилни заместители в радикала, особено # 945-позиция, двойни връзки, или появата на втория карбоксилни групи води до увеличаване на киселина характер.
1. карбонови киселини могат да образуват соли с метали, техни оксиди и хидроксиди, амоняк:
2. Характеристики взаимодействие на карбоксилни киселини е тяхната способност да образуват с алкохоли в присъствие на минерални киселини, естери - реакция на естерификация:
Ролята на катализатор в реакции на естерификация играе водородни йони. Естерификация механизъм реакция е описан, както следва:
а) кислородния атом на карбонилната група на киселината, улавяне протон, образува carbocation I:
I carbocation отдава алкохол молекула поради самотен електронни двойки на кислородния атом за образуване на междинно съединение четиристенен комплекс II, който е способен на обратимо с вода, за да се разпадне и да образуват нови разцепване carbocation естер III. образува естер, освободената катализатор протон дисоциация на последния.
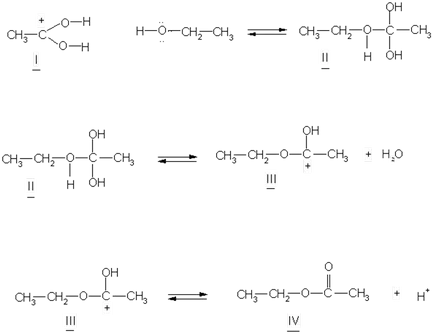
От голям интерес е хидроксил на въпросната киселина или алкохол разцепва в реакции на естерификация.
Използвайки "следящият индикатор" (тежка кислород изотоп 18 О) показва, че водата на естерификация, образуван от водород и хидрокси киселина алкохол:
Естери също се получават чрез взаимодействие с алкохоли и galogenatsilov алкохолати и соли на карбоксилни киселини с алкилови халиди и отопление действие на алкохоли за киселинни анхидриди:
Естери на нисши алкохоли и киселини - течни с приятна миризма, в някои случаи, наподобяващи миризмата на плодовете. Например: изоамилов - круша същност.
За типичен естерна хидролиза и реакция на трансестерификация:
3. Под действието на фосфорни халогениди и серни халогениди на карбоксилни киселини се образуват киселини. В този случай, както е в случая на алкохоли, заместени с халоген хидроксил:

киселинни халогениди могат да се наричат с киселина и халоген, например маслена киселина бромид. Но по-често те се наричат киселинни радикали - ацил. Преди да показва името ацил халогенна:
Долна халогениди - течност с много остра миризма, дразнещи лигавиците.
Galagenangidridov Чрез взаимодействие със съединения, съдържащи метален атом или активен водороден атом се заменя му киселинна част - ацил. Такива реакции на ацилиране се наричат да получава и да позволи на всички киселинни производни: анхидриди, киселини, естери, амиди, пероксиди и т.н.
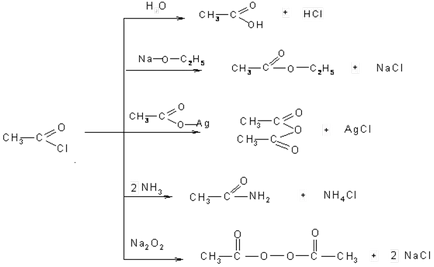
Всички тези реакции са реакции на нуклеофилно заместване и са в повечето случаи на тетраедални механизъм.
4. дехидратиране киселини или кисели соли чрез взаимодействие с анхидриди се образуват киселинни халогениди:
Киселинни анхидриди на долната - подвижна течност с остра миризма; във вода са слабо разтворим или не разтворим. Оставя се да кипи при по-висока температура, отколкото съответната киселина.
киселинни анхидриди имат висока реактивност и са халиди, ацилиращи агенти добро:
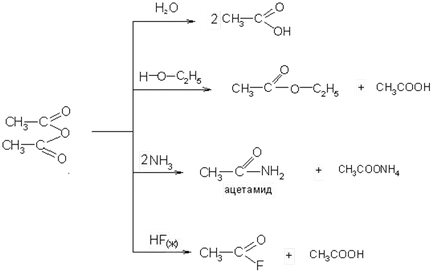
От голямо значение е реакцията на производство на флуорид.
5. При преминаване пари на киселини с амоняк над катализатор, получен чрез дехидратиране на амиди на киселини:
киселинни амиди получени както NH3 ефект върху халогениди или киселинни анхидриди или амониеви соли на киселини:
Киселинни амиди - кристални вещества (с изключение на течност мравчена киселина - формамид).
Амиди, чрез чифтосване на свободен електронен чифт азот с карбонил кислород, почти никакви основни свойства
Най-важният за реакцията на амиди са:
а) хидролиза в кисела или алкална среда
б) дехидратиране в присъствието на фосфорен пентаоксид
На нитрили подробности киселини виж глава "азот-съдържащо съединение."
6. халоген-заместени киселини могат да бъдат получени чрез действието на молекулен хлор или бром карбоксилна киселина. най-лесно # 945; перхалогенозаместен производни се получават от киселини, анхидриди и халогениди: