Синтез газ
Първият метод за производство на синтетичен газ е газификация на въглища, която се провежда в 30-те години на XIX век в Англия, за да се получат горими газове от водород, метан, въглероден окис. Този процес се използва широко в много страни до средата на 50-те години на XX век, а по-късно е изместен от методи, основани на използването на природен газ и петрол. Въпреки това, се дължи на намаляване на стойността на петролните ресурси на процеса на газификация започва да расте отново. В момента има три основни промишлени метод за производство на синтетичен газ. 1. Газификация на въглища. Методът се основава на реакцията на въглища с водна пара:
Тази реакция е ендотермична, равновесието се измества надясно при температура 900-1000 ° С Технологичните процеси, които използват пара кислород разпенващ, където споменатите реагиращи заедно с екзотермична реакция на изгарянето на въглища, което осигурява желания топлинния баланс:
2. Превръщане на метан. Реакция на метан с взаимодействие на водната пара се провежда в присъствието на катализатор никел (Ni-Al2 О3) при повишени температури (800-900 ° С) и налягане от:
Всяко въглеводородна изходна суровина може да се използва като суровина вместо метан. 3. Частичното окисление на въглеводороди. Процесът включва частично термично окисление на въглеводороди при температури над 1300 ° С:
Методът е приложим за всеки въглеводород суровина, но най-често в производството на използването на висока точка на кипене нефтена фракция - масло. CO съотношение. Н2 зависи основно от процеса за производство на синтетичен газ. В газификация на въглища и частично окисляване, съотношението е близо до 1. 1, докато съотношението между метан CO превръщане. Н2 е 1. 3. Проектите се разработват подземен газификация, т.е. газификация на въглища директно в образуването. Интересното е, че тази идея беше изразено от DI Менделеев преди повече от 100 години. газ Терминът синтез ще получите не само газификацията на въглища, но също така и от други източници на въглерод до общински и селскостопански отпадъци.
въглероден оксид, метални карбонили и електрон правило 18
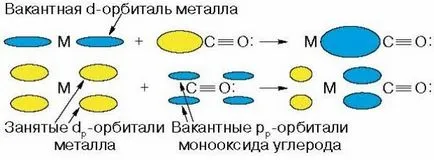
Многобройни синтези на базата на въглероден окис и водород са огромни както практически и теоретичен интерес, тъй като те позволяват на два прости вещества се полезни органични съединения. Тук решаваща роля играе катализа с преходни метали, които са способни да активират инертни молекули на СО и Н2. Активирането на молекули - е превръщането им в по-реактивен състояние. От особено значение е, че при превръщането на синтетичен газ широко разработи нов тип катализа - (. Виж О. Temkin статия [4]) катализа на преходни метални комплекси или метален комплекс катализа. Така дали инертен молекула на СО? Представителства на инерцията на въглероден оксид са условни. Повече godu Mond през 1890 г., получена от метален никел и въглероден окис първи метален карбонил съединение, летлива течност с точка на кипене от 43 ° С - Ni (CO) 4. Интересува се от историята на това откритие, което може да се дължи на случайността. Mond, проучване на причините бърза корозия на никел реактори в производството на сода NaCl, амоняк и СО2. установено, че причината за корозия е наличието на примеси в СО2 на въглероден окис, който реагира за образуване никелов тетракарбонил Ni (CO) 4. Това откритие оставя Mond нататъшно развитие на методите за пречистване на никел от получаване летливи никел карбонил и последващо разлагане отново към никел и SB. След 25 години и е случайно отвори карбонил желязо - Fe (CO) 5. Когато BASF компанията отвори отдавна забравени стомана бомба с СО в дъното открити жълта течност - желязо ПЕНТАКАРБОНИЛ, което постепенно се образува от реакцията на желязо метал с СО при повишено налягане. Тъй като металните карбонила са силно токсични съединения, свързани с тях първоначално химици е доста хладни, но впоследствие са открити изненадващи свойства, включително катализатор, се определя тяхната широка употреба, особено в химията на въглероден окис. Имайте предвид, че много от металите във фино раздробена форма може да бъде директно взаимодейства с въглероден монооксид, но по този начин получава само желязо и никел карбонили. Други метални карбонили, получени в намаляване на техните съединения в присъствието на СО при високи налягания. Състав на карбонилни комплекси на преходни метали могат да бъдат предвидени на базата на правилото 18, електроните, като комплекс е стабилен, ако количеството на метал от валентните електрони и електроните, предоставена от лиганда, в този случай, CO, ще бъде равна на 18, тъй като в този случай електронен конфигурация съответства на стабилна конфигурация благородни атома газ (криптон). Молекулата на въглероден окис е несподелени електронни двойки, където може да бъде осигурен на двойка електрони на въглерод за образуване на връзка с метал от тип донор-акцептор. Като пример, помисли за структурата на желязо и никел карбонила Fe (CO) 5 и Ni (CO) 4. желязо и никел атоми имат 8 и 10 валентните електрони и за запълване на електрони обвивка на атома, към конфигурацията на благороден газ атом криптон липсва 10 и 8 електрони, и така образуването на карбонил желязо атом трябва да осигури електронни двойки пет молекули от СО и атом на никел - четири , Преходни метали с нечетен брой на валентните електрони образуват двуядрени карбонилни комплекси. Така, кобалт като девет валентните електрони на стабилна електронна конфигурация липсва девет електрони. Мононуклеарни комплекси поради приемането на четири двойки CO молекули ще имат несдвоени електрони, и радикал характер такива частици взаимодействат един с друг за образуване на метал-метал, и резултатът е димерен комплекс на Со2 (СО) 8. Реакцията на въглероден окис или координация с метал води до преразпределение на електронната плътност, не само CO, но и на метали, която значително влияе на реактивността на карбонил комплекс. Най-често срещаният тип на така наречените линейни координира СО:
Когато това се случи не само S-взаимодействие поради свободен електронен чифт въглерода, но също р-Реакцията поради електронен трансфер с г-орбиталния на метала на енергията наличните свободни орбитали на въглерод: