примери Донор-акцепторни механизъм
Химическа връзка се нарича връзка между две или повече атоми (молекули) в органичен или неорганичен съединение. Тя се формира чрез намаляване на общата енергия, предоставяна на системата.
ако всички елементи могат да образуват химически връзки
Всички елементи на периодичната система имат различна способност за формиране на облигации. Най-стабилната и като резултат, са химически по-малко активни атоми благородни (инертни) газове, защото те съдържат най-външната обвивка на електрони от две или осем електрони. Те образуват малък брой връзки. Например, неон, хелий и аргон не образува химически връзки с нито един елемент, докато ксенон, криптон, радон, и може да реагира с флуорни и водни молекули.
Атомите други елементи външни нива не са завършени и са един до седем електрони, така че да се увеличи стабилността на черупката да образува химически връзки.
Видове химични връзки
Няколко различни видове комуникация:
ковалентна връзка
Този тип връзка е образувана между атома в молекулата, което води до социализация или припокриване на валентност електрон двойка. Съответно, има обмен (а) и донор-акцептор (б) механизми за образуване на ковалентна връзка. Отделен случай е сменяем връзката, която ще бъде обсъдено по-долу.
Ковалентна връзка: обмен механизъм
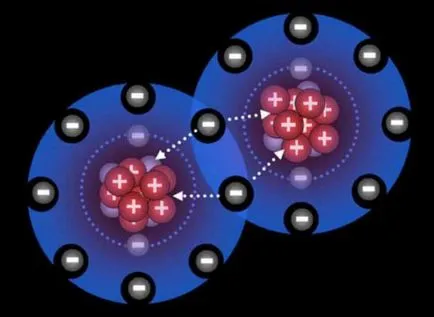
Атомите на външното ниво има несвоен електрони. В реакцията на припокриване на външната обвивка. Антипаралелен завъртания единични електрони, съдържащи се във външните нива чифтосват да образуват двойки електрони споделени от два атома. Тази двойка електрони е, в действителност, ковалентна връзка, която е оформена в механизъм за обмен, например, водороден молекула.
Ковалентна връзка: механизъм донор-акцептор
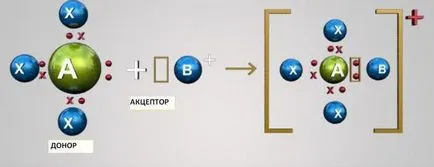
Този механизъм се състои в социализация два атома на два електрона са външно. В този случай един от атомите действат като донори (предоставени от две електрони) и от друга - на акцептор (който има свободен орбитален за електрони). Атомите на S- и р-компоненти могат да бъдат или акцептори или донори на електрони. Атомите г-елементите могат да бъдат донори и акцептори.
За да се разбере какъв механизъм донор-акцептор, помисли два прости примери - образуването на хидрониев катиони H3 О + и амониев NH4 +.
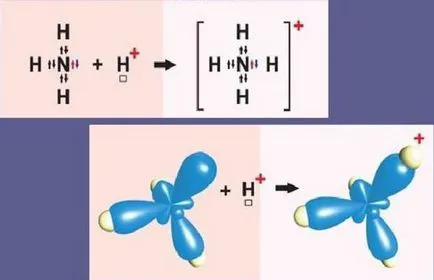
Пример за механизъм донор-акцептор - амониев катион
Схематично, реакцията на образуване на амониев частици е както следва:
Електроните в атом N са разпределени в следния ред: 1s 2 2s 2 2p 3.
Електронни катион структура H: 1s 0.
Азотният атом на външната ниво включва две s- и р-три електрон. Три р-електрон участва в образуването на три ковалентна връзки тип обмен азот-водородна връзка N-H. Това води до молекула на амоняк NH3 с ковалентна връзка. Тъй като азотния атом N външно има друга двойка електрони S, NH3 молекула може също придават водороден катион. Амонякът е донорната молекула и водороден катион Н + - акцептор, която приема електрони от донор азот собствена S-орбитален.
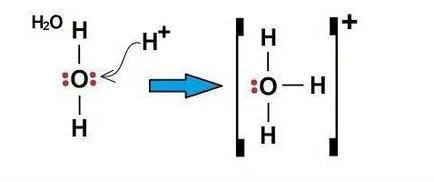
Пример за механизъм донор-акцептор - H3O (хидрониев йон)
Електроните в кислороден атом, разпределени в следния ред: 1 S 2 2s 2 2p 4.
кислороден атом в външната ниво има два S и четири р-електрони. Съответно, в образуването на Н-O връзки, са включени две свободни р-електрони и две от S-електрон атоми две Н. Това означава, че два налични връзки в молекулата Н2 О - ковалентни образувани в механизма обмен.
Електронната структурата на катион водород: 1s 0.
Тъй като кислородният атом на външната ниво бяха още два електрона (S-тип), той може да образува ковалентна връзка трети тип механизъм донор-акцептор. В акцептор може да бъде атом, имащ свободна орбитален, в този пример, частиците Н +. Свободните S-орбитални на + катиони H заемат два електрона (и) кислороден атом.
образуване Донор-акцептор механизъм ковалентна връзка между неорганични молекули
Донор-акцептор механизъм ковалентна връзка е възможно не само в тип взаимодействие "атом атом" или "молекула-атом", но в реакциите, настъпващи между молекулите. Единственото изискване за донор-акцептор взаимодействие е кинетично независими молекули е намаляване на ентропията, с други думи, увеличаване на реда на химичната структура.
Разглеждане на първия пример - образуването на апротонен киселини (Люисови киселини) NH3 BF3. Неорганични активен комплекс се образува в реакционната допълнение молекула на амоняк и борен флуорид.
Електроните в един атом на борен разпределени в следния ред: 1 S 2 2s 2 2p 1.
При възбуждане на един електрон ключове атом B и тип на р-подслой (1s 2s 1 2 2p 2). По този начин, външно възбуден борен атом е два s- и р-две електрон.
Молекулата BF3 три ковалентна бор-флуоро B-F са образувани чрез обмен тип (бор и флуорни атоми осигуряват един електрон). След образуването на три ковалентни връзки в борния атом, към външната електрони обвивка остава свободна р-подслой, чрез което борен флуорид молекула може да действа като акцептор на електрони.
Електроните в азотен атом разпределени в следния ред: 1 S 2 2s 2 2p 3.
Три електрон от N и Н атоми са включени в образуването на азот-водородни връзки. След това, азотът остава още два електрони е тип, че да може да се осигури свързване на механизма за донор-акцептор.

В реакцията на борен трифлуорид и амоняк NH3 молекула действа като донор на електрони и BF3 молекула - акцептор. Чифт електрони азот заема освободи орбитален на борен флуорид и химичното съединение се образува NH3 BF3.
Друг пример на механизма на образуване на донор-акцептор връзка - получаване берилий флуорид полимер.
Схематично, реакцията е както следва:
Електроните в един атом са подредени така да бъде - 1s 2s 2 2. атом и F - 1s 2s 2 2 5 2p.
Две-флуоро комуникация берилий берилий флуорид в молекула тип обмен ковалентна (включва два р-електроните на двете флуорни атоми и два електрона S-подслой берилий атом).
Между двойка атоми берилий (BE) и флуор (F) са образувани от още две ковалентни връзки на механизма за донор-акцептор. полимер берилий на флуорид флуорен атом - е електрон донорен атом берилий - тяхното акцептор като свободна орбитален.

образуване Донор-акцептор механизъм ковалентна връзка между органични молекули
Когато е налице връзка, механизмът на образуване на субекта между молекулите на органичен характер, комплекс съединение формира - комплекси. При всяко органично съединение с ковалентна връзка, съдържаща като зает (необвързваща и свързване) или празни орбитали (дезинтегриращи и необвързваща). Способността на образуване на комплекс донор-акцептор се определя от степента на стабилност на комплекса, което зависи от силата на връзка.
Да разгледаме пример - реакцията на метиламин с взаимодействието на молекулата с хлороводородна киселина до образуване метил амониев хлорид. Във всички връзка метиламин молекула ковалентна оформен в механизма обмен - две връзки H-N връзка и една N-СН3. След съединението с водород и метилова група при азотния атом има двойка електрони и тип. Като донор, тя осигурява електронен чифт водороден атом (акцептор), което има свободна орбитален.

Донор-акцептор механизъм без да образува химическа връзка
Не във всички случаи, взаимодействието на донор-акцептор настъпва социализация и електронна двойка връзка формация. Някои органични съединения могат да се комбинират един с друг поради припокриването на орбитали донор изпълнен с празна орбитала на акцептор. Charge прехвърляне възниква - делокализирани електрони между донора и акцептора, разположен в непосредствена близост един до друг. Образуваните комплекси с пренос на заряд (CTC).
Такова взаимодействие е характерно за PI-системи, които са лесни орбитален припокриване и електроните са лесно поляризирани. Ролята на донори може да действа металоцени, ненаситен амино съединение, TDAE (тетракис (диметиламино) етилен). Акцептори са често фулерени quinodimethane като акцепторни заместители.
Прехвърлянето на зареждане може да бъде или частична или пълна. Пълен пренос на заряд се случва по време на фотовъзбуждане на молекулата. Това образува комплекс, който може да се наблюдава спектрално.
Независимо от пълнотата на пренос на заряд, такива комплекси са нестабилни. За да се увеличи силата и живота на такова състояние допълнително въвеждане на мостова група. В резултат на донор-акцептор система се използва успешно в слънчеви устройства за преобразуване на енергия.
В някои органични молекули връзка на механизма на донор-акцептор е оформен в молекулата между донор и акцептор група. Този тип взаимодействие се нарича transannular характеристика ефект, например, за Atrani (органометални съединения с връзки N-> B, N-> Si).
Семиполярна връзка или сменяем механизъм образуване на връзка
Освен обмен и донор-акцептор съществува трети механизъм - сменяем (различни имена - семиполярна, семиполярни или координация връзка). Atom донор дава свободна двойка електрони на орбитала на неутрален атом, който се нуждае от два електрона за завършване на външната ниво. Това е един вид на преминаване на електронната плътност от донора на акцептор. В този случай, на донора става положително заредени (катион) и акцептор - отрицателно зареден (анионен).
Всъщност химична връзка се образува чрез свързване на черупката (припокриване две двойки електрони от един атом на друга външна свободен орбитален) и електростатично привличане генерирана между катион и анион. Така, в семиполярна връзка комбиниран ковалентна и йонни видове. Семиполярна характеристика връзка на г-елементи, които са в различни съединения могат да играят роля и акцептора и донора. В повечето случаи, това се случва в комплекс и органични вещества.
Примери за комуникация сменяем
Най-простият пример - молекула хлор. Един Cl атом изпраща двойка електрони на друг атом на хлор, което е свободно г-орбиталния. Така една Cl атом е положително заредена, а другата - отрицателен, и електростатично привличане настъпва между тях. Поради голямата дължина на сменяем връзката е по-слаба в сравнение с обмен ковалентна и донор-акцептор тип, но неговото присъствие увеличава силата на хлорни молекули. Ето защо Cl2 молекула е по-стабилен от F2 (не флуорен атом в г-орбитали, комуникация флуоро-флуоро само ковалентна обмен).
Молекулата на въглероден монооксид CO (въглероден оксид) е оформен от три връзки CO. Тъй като кислород и въглеродни атома външно има две единични електрони, образувайки две ковалентна връзка обмен между тях. След това, въглеродният атом остава свободни орбитален в атом О - две двойки електрони на външната ниво. Следователно, в молекулата, въглероден оксид (II) има трета връзка - семиполярна се образува от две сдвоени валентните електрони на кислород и свободни въглеродни орбити.
Да разгледаме по-сложен пример - образуването на този вид комуникация като например взаимодействие на диметилов етер (H3C-О-СН3) с алуминиев хлорид AlCl3. кислороден атом в DME свързани чрез ковалентни връзки с две метилови групи. След това, той остава още два електрона на р-подниво, което дава атом акцептор (алуминий) и се превръща в положителен катион. Така акцепторен атом придобива отрицателен заряд (анион се превръща в). Катионът и анион електростатично взаимодействат един с друг.
Значение донор-акцептор връзка
Механизмът на образуване на донор-акцептор връзка а е от съществено значение за живота и е широко разпространен в химични съединения, както органичен и неорганичен характер, както се потвърждава от дискутираните по-горе примери. Амоняк, като част от която има амониев катион, се прилага успешно в ежедневието, медицина, и промишленото производство на торове. Хидрониев йон играе важна роля в разтварянето на киселината във водата. Въглероден моноксид се използва в промишлеността (например, при производство на торове, лазерни системи) и е от голямо значение в физиологични системи на човешкия организъм.
