Постоянен диполен момент
Метод поява дипол
По време на образуването на ковалентни връзки на полярни атоми на една силна привлича електрони, което води до общо електронна двойка смени към ядрото. Има полярен ковалентна връзка. Способността на един атом да привлече критерий електрони е неговата Електроотрицателност (ЕО). Колкото по-висока електроотрицателност на атом е по-голяма вероятността за изместване на електронна двойка в посока на ядрото на атома. разлика EO атоми характеризират връзка полярност.
В резултат на изместването на електронна двойка на основата на един от атомите увеличава отрицателен плътността на заряда в даден атом, и той получава ефективно заряд атом $ \ делта ^ - $. Другите атоми увеличава плътността на положителния заряд на $ \ ^ делта + $. Има дипол - електрически неутрален система с две еднакви по размер, но противоположни по знак на такси, разположени на определено разстояние (дължината на дипол $ l_d $ в) един от друг.
Постоянен диполен момент
Мярка за полярността на диполен момент $ \ МУ $. Неговата стойност е равна на произведението на действителното съдържание на $ \ делта $ от дължината на дипола l_d $ $:
Единица постоянен диполен момент - Кулон на метър ($ Cl \ cdot m $) или извън системата единица мярка - Debye $ D $, е равна на 3,34 $ \ cdot 10-30 Cl \ cdot $ m.
Да предположим, че в молекулата на HF $ HF $ - йонна връзка. Това означава, че водородните атоми и флуорни концентрира такси $ + $ 1 и $ $ 1, съответно. Обвиненията на йоните са кратни на заряда на електрона, равен на $ 1,60 \ cdot 10 ^ $ Cl. Разстоянието между обвиненията е $ 9,17 \ cdot 10 ^ m $ постоянен диполен момент, от тези данни, е .:
$ \ Mu = р \ cdot R = 1,60 \ cdot 10 ^ Kl \ cdot 9.17 \ cdot 10 ^ т = 1.47 \ cdot 10 Kl \ cdot $ m.
диполен момент на Дебай е:
Стойността $ \ мю = 4,40 D $ характеризира диполен момент на молекула $ HF $ от при условие, че химичната връзка него напълно йонен. В действителност, $ \ мю = 1,83 D $ на. Сравнявайки тези стойности, може да се изчисли "ionicity акции облигации" (частично йонна характер) в молекула $ HF $ на.
С увеличаване на разликата на електроотрицателност постоянен диполен момент се увеличава.
момент дипол е количество вектор. условно приемане посока дипол от отрицателния полюс на положителното.
В молекули $ NH_3 $ амоняк и азот флуорид $ NF_3 $ идентичен триъгълна - пирамидална форма (Фигура 1.). Полярност връзки $ М-Н $ и $ N-F $ е почти същото. Въпреки това, диполен момент на амоняк е равно на 0,49 $ \ cdot 10 ^ Cl \ cdot m $ и азот флуорид - 0,07 $ \ cdot 10 ^ Cl \ cdot $ m. Тази разлика се обяснява с факта, че амоняк молекула посока диполен момент свързване $ М-Н $ и необвързващи електронна двойка съвпада с допълнение вектор води до по-голям електрически диполен момент. Под азотна флуорид молекула диполни моменти връзки $ N-F $ електронна двойка и ориентирани в противоположни посоки. Ако ги добавите, след което се извършва частична компенсация.
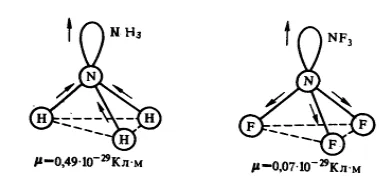
Фигура 1. Посоката на моменти дипол и електронни двойки в молекулите $ NH_3 $ амоняк и азот флуорид $ $ NF_3
За многоатомни молекули, е необходимо да се прави разлика между диполен момент на отделните връзки и молекулата като цяло. Ако молекулата съдържа няколко връзки, техните електрически моменти (вектори) са образувани чрез правилото за успоредник. Получената дипол момент ще бъде различен от електрическите диполни моменти на отделните връзки. Ако молекулата е много симетричен, момента, в който дипол може да бъде нула, а индивидуална комуникация имат висока полярност.
Решете контрол по всички предмети. 10 години опит! Цена от 100 рубли. период от 1 ден!
Молекула е линейната форма на въглероден диоксид е неполярни ($ \ ц = 0 $), като всяка връзка $ С = О $ има значително диполен момент ($ \ ц = 8.9 \ cdot 10 ^ Cl \ cdot $ т). Това се дължи на факта, че с еднаква амплитуда, връзки с постоянни диполни моменти са насочени един към друг.
По-полярните молекули и по-големи общи електронни двойки са изместени една от атоми, още повече стойността на постоянното диполен момент.
Методи за определяне на постоянен диполен момент
Обикновено, методите за определяне на електрически дипол моменти въз основа на подреждането на ефекта ориентация на полярните молекули в електрическото поле приложен.
Методи микровълнова спектроскопия. Въз основа на ефектите на срязване и разделяне на спектрални линии в електрическото поле. Това дава възможност за по-точно определяне на стойността на големината и посоката на вектора на постоянен дипол момента. Тези методи включват: метода на Старк, резонансната метод микровълнова фурна, молекулно лъч, и др.
Методи, основани на измерване на диелектрична константа на $ \ varepsilon $ вещество.
диелектрична вещества, измерени при различни температури. Ако веществото се поставя в електрическо поле, генерирано от кондензатор, капацитет ще се увеличи. време, което означава,
където $ c_0 $ и $ C $ - кондензатор във вакуум и веществото в средата.
Енергията на електрическото поле в кондензатора е равна на:
където $ U $ - електрическа енергия поле в кондензатора;
$ C $ - капацитет материали в околната среда;
$ V $ - напрежение на кондензатор плочи.
среда кондензатор вещество има по-голям енергийно съдържание, отколкото във вакуум. Това се дължи на факта, че електрическото поле предизвиква ориентацията на дипол и деформация на молекулите на веществата.
Постоянен диполен момент е намерена от уравнението Lanzheneva - Debye, който се свързва температурната зависимост на диелектрична константа и диполен момент:
където $ M $ - относителна молекулна маса на веществото;
$ N_a $ - Числото на Авогадро;
$ K $ - Болцман константа, която е равна на $ \ Фрак $;
$ R $ - универсална константа газ;
$ \ Алфа $ - деформация поляризуемост.
Чрез измерване на $ \ varepsilon $ на два температури с помощта на уравнението Langevin - Дебай възможност да се определи деформация поляризуемост и постоянен диполен момент.
Познаването на размера на диполен момент, може да показва характера на химичната връзка (ковалентна полярен или неполярен, йонен) и съди геометрична структура на молекулата.