Получаване и използване
NO2 се получава чрез каталитично окисление на амоняк в излишък на кислород или окисление на NO в въздуха:
както и от реакции:
При стайна температура NO2 - газ тъмно кафяв цвят, има магнитни свойства, дължащи се на присъствието на несдвоен електрон. При температури под 0 ° С NO2 молекула димеризира в двуазотен тетраоксид, където -9.3 ° С димеризация протича напълно: 2NO2 N2O4. В течно състояние nedimerizovano само 1% NO2, но остава под формата на 10% N2O4 димер при 100 ° С
NO2 (или N2O4) взаимодейства в топла вода за образуване на азотна киселина: 3NO2 + H2O = 2HNO3 + NO. Следователно NO2 технология е много важно, тъй като междинен етап на получаване на промишлено важен продукт - азотна киселина.
Азотният оксид (V) N2O5 - бяло кристално вещество, получено чрез дехидратиране на азотна киселина в присъствието на фосфорен оксид Р4О10 (оттеглено анхидрид азотна киселина.):
N2O5 лесно се разтваря в атмосферна влага, повторно формиране HNO3. Свойствата се определят от равновесие N2O5
N2O5 - добър окислител реагира лесно, понякога бурно, с метали и органични съединения в чисто състояние, когато се нагряват експлодира. Най-вероятно структурата на N2O5 може да бъде представен като
Oxoacids от азот. За азот три известни oxoacids: gipoazotistaya H2N2O2, азотен и азотна HNO2 HNO3.
Gipoazotistaya киселина H2N2O2 - много нестабилно съединение, се образува в неводна среда на метална сол тежки - giponitrita друга под действието на киселина: M2N2O2 + 2HX 2MX + H2N2O2. След изпаряване на разтвор, получен бял взривно вещество с предложената структура Н-О-N = N-О-Н.
HNO2 азотиста киселина не съществува в чиста форма, но неговите водни разтвори с ниска концентрация, образувани чрез добавяне на сярна киселина, за да нитрита на бариев:
Азотиста киселина и се образува чрез разтваряне на еквимоларна смес от NO и NO2 (или N2O3) във вода. Азотиста киселина малко силна оцетна киселина. Степента на окисление на азот в 3 (структурата Н-О-N = О), т.е. той може да бъде окислител и редуктор. Под действието на редуциращи агенти е обикновено възстановени NO, и чрез взаимодействие с окислители се окислява до азотна киселина.
Скоростта на разтваряне на някои вещества, като например метали или йодиден йон, азотна киселина зависи от концентрацията на настоящото азотиста киселина като примес. Соли на азотиста киселина - нитрити - са лесно разтворими във вода, с изключение на сребърен нитрит. NaNO2 се използва в производството на бои [15,9,14].
Получаване и primenenieazota
В лабораторията, азот може лесно да бъде получен чрез нагряване концентриран амониев нитрит:
NH4NO2 = N2 + 2Н2
В лабораторни чисти ( "химически") се получава чрез добавяне на азот при нагряване на NH4CI наситен разтвор на амониев хлорид към твърдата NaNO2 натриев нитрит при нагряване:
NaNO2 + на NH4CI = NaCl + N2 + 2H2O
О. технически метод за получаване на азот се основава на разделянето на предварително втечнен въздух, който след това се подлага на дестилация. За този първи охладен въздух се втечнява и течен въздух се подлага на дестилация (дестилация). Точката на кипене на азот е малко по-ниска (-195,8 ° С), различни от въздух компоненти - кислород (-182,9 ° С), следователно, първо азота изпарява с леко загряване течен въздух. Потребителите азотен газ се доставя в компресирана форма (150 атм., Или 15 МРа) в черни цилиндри с жълт надпис "азот".
По-голямата част от произведената свободен азот се използва за промишленото производство на амоняк, който след това в значителни количества се обработва в азотна киселина, торове, взривни вещества, и така нататък. D. В допълнение към директен синтез на амоняк от елементите на промишлено значение за свързването на азот във въздуха е разработила през 1905 метод цианамид, въз основа на факта, че калциев карбид 10000S (получен чрез нагряване на смес от въглища вар в електрическа пещ) реагира със свободния азот:
CaC2 + N2 = CaCN2 + C
Получената калциев цианамид, чрез действието на прегрята водна пара разлага да освободи амоняк:
CaCN2 + 3H2O = СаСО3 + 2NH3.
Азот-свободен достъп се използва в много индустрии .. Както инертна среда в различни химически и металургични процеси, за запълване на празното пространство в живачни термометри, при изпомпване на запалими течности и др течен азот намира приложение в различни хладилни системи. Той се съхранява и транспортира в Dewar съдове стомана, азотен газ се компресира - в цилиндъра. Широко се използват много азотни съединения. Производство на фиксиран азот беше енергично се развие след първия световна война и е достигнал огромни размери. [14]
Експериментална част. Получаване разлагане на амониев нитрит азот
Азот беше получен в лабораторията чрез взаимодействие на наситен разтвор на амониев хлорид и калиев нитрит. Получената метатеза амониев нитрит се разгражда лесно да образуват азот и вода.
Хардуер: Флакон Wurtz делителна фуния, тръба пара, трески, стъклен цилиндър, калъп, стъклена плоча, статив горелка.
Безопасност. Спазвайте правилата на нагревателите.
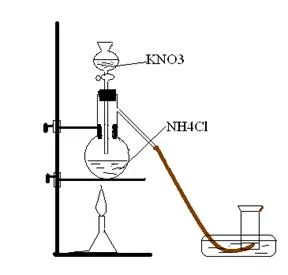
Експеримент: В колба Wurtz налива разтвор на амониев хлорид 20 мл и фуния за изкапване разтвор на калиев нитрит. При изливане калиев нитрит, чрез отпадане еволюция фуния азот започва на колбата. На първо място, реакцията протича бавно и след това се ускорява. Необходимо е да се нагрее колбата с амониев хлорид, ако реакцията не е достатъчно бързо.
KNO2 + на NH4CI = KCl + NH4NO2
NH4NO2 = N2 + 2H2O
Поставянето на догонване цилиндъра с азот. Трябва да се съберат по следния начин: напълнена с вода цилиндър да се обърнат с главата надолу и се слага в мухъл с вода и да доведе до тръбата на пари. Той е безцветен газ, умерено разтворима във вода. Изгарянето раздробят под азот изгасва. Оставете се отвори на цилиндъра, след известно време ще направи една запалена подпалка в цилиндъра отново. Splinter престой. Азотът се изпарява от цилиндъра. Азотът е малко по-лек от въздуха.
И когато се формира sbaltyvanii варовиков вода в цилиндъра с утайката на азот, за разлика от разбъркване с въглероден диоксид.
Заключение: В резултат на синтеза на азотен получен че потвърдена чрез експерименти [17].
Азотът е много важен и интересен елемент не само в областта на химията, но и за chelovechetva цяло. В голяма част от азота се среща в природата в свободно състояние. 2 има стабилен изотоп. молекула му е много стабилен и малко реактивен само при много високи температури, реагира с различни метали и неметали. Намерено някои сходство с азотния атом, въглероден атом.