Полярни и неполярни молекули - химичната връзка - общ химия, химията помощ за въвеждане
Гид за ХИМИЯ ЗА КАНДИДАТИТЕ в държавните висши училища
Част I. Общи Chemistry
Раздел 3. Химически облигации
§ 3.4. Полярни и неполярни молекули
Едностранно поляризация произвежда неравномерно разпределение на електронната плътност в молекулата. Например, в HC л молекула електронната плътност на сърцевината на хлор е по-висока от тази на водородни ядра. Електрически центрове на положителни и отрицателни заряди в молекулата не съвпадат в един момент, и са на разстояние L (фиг. 3.12). Молекула с обща неутралност представлява електрически дипол с пачката - р у хлорен атом и а + р водороден атом. Такива връзки и молекули са наречени полярни. Такси на атомите в молекулата нарича ефективен такси Q (HC молекула в С л р л = -0.18, N = 0.18 р абсолютен заряд
електрон ionicity комуникация 18%).
Измерва полярността на молекулата и - електрически момент ц ( "ц") на дипол определя от продукта
където Q - ефективното заряд; L - дължина на дипол.
Според международната система единици на стойността на електрическата диполен момент, изразена от 3.33 • Cl • 10 -30 m (Кулон-метър).
Електрическият диполен момент - векторна величина. Посока на конвенционално взети от положителните към отрицателните товари - в посоката на преместване на свързващото вещество с електронен облак.
Електрически диполни моменти определят експериментално за различни връзки и големи количества вещества (те имат стойност от 0 до 36,6 ∙ 10-30 Cl • т).
Необходимо е да се прави разлика полярността на молекулите на полярността на връзката. За двуатомни молекули тип АВ, тези понятия са същите, както е показано в Пример л NA молекула.
В тези молекули, толкова по-голяма разлика в Електроотрицателност елементи, толкова по-голяма електрическа диполен момент.
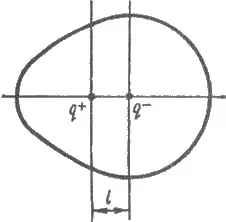
Фиг. 3.12. Polar молекула с постоянен електрически диполен момент
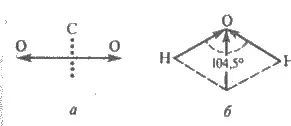
Фиг. 3.13. Геометрични моменти присъединителни електрически връзки на диполи в молекулите на CO2 (а) вода и (б)
В многоатомни молекули, връзката между атоми може да бъде полярен, самите молекули и, в зависимост от структурата на пространствено може да бъде или полярен или неполярен. Електрически диполен момент в молекулите определят от броя на полярни връзки и napryamlenіstyu. Той е вектор сумата от диполни моменти на отделните връзки. Например, електрическа диполен момент връзката 10 -30 С = О е 9 ∙ ∙ Cl 10 -30 m, и молекули на СО2 - нула. Това е така, защото линейни CO2 вектор молекулни връзки радиално насочени от центъра, и следователно получената момент ц е нула (фиг. 3.13, а). В молекула Н2 О ъгъл връзка има ъгъл на 104,5 ° и векторната сума на двете връзки се изразява с диагонал на успоредник (допълнение вектор се извършва в съответствие с принципите на успоредника на силите, Фиг. 3.13, б). За вода μ = 6,1 • 10 -30 Cl ∙ m. Ако получените геометрични вектори различни електрически дипол моменти не е нула, молекула полярния.
От друга страна, стойността и посоката на μ може да се съди до известна степен на геометрична структура на молекулата. Например, за молекули SO 2 μ = 5,4 ∙ Cl • 10 -30 m. Очевидно е, че е молекула вода, трябва да има ъглова структура.
Молекули, които съдържат неполярен ковалентна връзка се наричат неполярен или хомеополярно. Свързването на такива молекули са симетрично разпределени електронен облак между ядра на двата атома и ядрата еднакво действат върху него. Един пример може да бъде прост молекулни вещества, състоящи се от атома на един елемент: Н2. F 2. С л 2. В2 т.н. Електрически диполен момент на молекули е нула. Както е отбелязано, много са неполярни молекули симетрично конструирани комплексни съединения, въпреки че връзката между полярни атоми в него. Вещества с неполярна ковалентна връзка малко.
Способността на молекули (и отделни връзки) поляризирани от външно електрическо поле, наречено polyarizovanіstyu. Това може да стане под влиянието на областта, генерирани от полярен молекулата приближи. Следователно polyarizovanіst е важно в химични реакции.
Винаги е важно да се вземе предвид полярността на молекулата и електрически дипол момента. Ostannіmzumovlena реактивоспособност вещества. Като цяло, колкото по-голяма електрическа диполен момент на молекулата, толкова по-реактивността на съединението. С електрически диполен момент тя е и свързани с тях вещества и разтворимост.
Полярните молекули допринасят за електролитна дисоциация на разтворени електролити в тях.