Пирол - химическа енциклопедия
Пиролил. те казват. 67.09 m .; bestsv. течност с хлороформ миризма. бавно потъмнява при престояване във въздуха; т. бали. 130 ° С, температура на топене. -23,4 0 ° С; 0.9698; 1.5086; м 5,17 · 10 -30 m · CI (в чиста количество), 6.00 · 10 -30 m · хлорид (воден разтвор на бензен с циклохексан.); -2364.2 кДж / мол. Хигроскопична, смесим във всички отношения с по-голямата част от орг. R -riteley лоша разтворимост. във вода (6 д в 100 г вода при 25 0 С). Молекула пирол плосък, полярен, дипол-посока от N атом на пръстена навътре. Пирол-geteroaromatich. Връзка. ароматен. система е образувана от две двойки електрони на двойните връзки и N атом свободна двойка електрони (р -izbytochny хетероцикъл). Пирол-М-Н киселина (рКа 17.5, вода). При обработката на Na или К или амиди в течен NH3. и р-ТА с метал в инертен р-erator получава Na- и К-соли на пирол, притежавани до алкилира и ацилирани с Н. атом литиева сол се получава чрез взаимодействие пирол с Li в течен NH3 или бутил- или фениллитий в етер стр -R '. N-Заместено пирол металиран бутил- или фениллитий в позиция 2 с реагент на Grignard в етер пирол лесно образува N-pirrolmagnievye производни, притежавани до алкилира и ацилира при С-2. За пирол характеристика р-ТА електрофил. заместване притежавани до preim. са при въглероден атом. Протонизирането пирол миньор. до трето води до нарушаване на системата и предизвиква полимеризация на ароматност (е оформен т. наречен. пирол-червено). Нитрирането ацетил пирол води до 2-nitropyrrole смес с 3-нитро; сулфониране на пиридин-SO3 комплекс в 100 0 С- да образуват пирол-2-сулфо-киселини. Когато много лесно формира р-ТА пирол халогенни tetragalogenpirrol. Активни халогениди (алил и бензилови халиди) в присъствието. слаби основи алкилира пирол в позиция 2 и 5, СН3 I при 100-150 0 ° С, и в позиция 3 и 4. Ацилирането пирол оцетен анхидрид при 100 0 ° С се получава смес от 2-ацетил и 2,5-diatsetilpirrolov. Наличието в 1-позиция с електрон-fenilsul fonilnoy група променя ориентацията на електрофил. заместване: ацилиране на 1-fenilsulfonilpirrola Friede-LU-Crafts селективно е в позиция 3. Под действието на HCN, солна киселина и POCl3 в DMF, CHCI 3 или в алкална среда се форматира да образуват пирол 2-формил-пирол. Когато се използва CHCI 3 поради образуването на dichlorocarbene е случаен р-ТА да се образува 3-хлоропиридин:
За р-ТА пирол Mannich преобразува. 2-диалкиламинометил-пироли. С активирана. алкени (акрилови естери до-ви, акрилонитрил. малеинов анхидрид и др.) в присъствието. на трет-пирол или основи влиза в р-нето, като р-ТА Майкъл, с образуването на алкилиране продукти в позиции 2 и 5. В отопление. с р-ром воден (NH4) 2 CO3 налягане пиролови карбоксилати до амониева сол пирол-2-карбонил-до-ви вой. В неутрална или слабо кисела среда влиза в р-ТА азо свързване до получаване на 2-азо производни в алкална среда дава бис-азо производни, напр.:
С ацетон в кисела среда образува цикличен пирол. тетрамер е-Ly I.

При умерено т-D и пирол налягане лесно хидрогенира в пиролидин (kat.-Pt, Pd, Ni-Реней). Чрез редукция с Zn и HCl т. Б. изолиран 3-пиролин. Air в светлина пирола се окислява до янтарна имид до вас, хром-към-едно в малеимидното.
На солна киселина р-D п-диметиламинобензалдехид (реагент Ерлих) пирол получава червен цвят, с SeO2 във воден р-D - виолетово с изатин образува синьо утайка. Пирол-общо идентифициран като комплекс с HgCl2 (точка на топене 143 0 ° С).
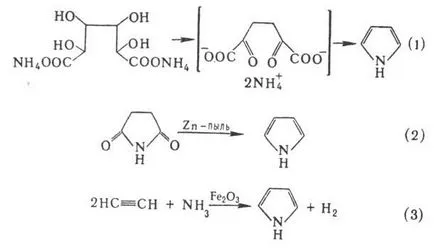
Получава пирол дестилация амониева сол лигава до-ви (вариант Paal-Knorr синтез, р-ТА 1) дестилация на янтарна га да-ти с цинков прах (2) преминаване на NH3 през ацетилена и се калцинира в тръбата за присъствие. оксиди на Fe (III) или Pb (3), katalitich. амонолиза фуран или тиофен в присъствие. Al2 O3 (р-ТА Yureva):
N irrol умерено токсичен; неговите пари да причинят упорит и постоянно увеличаване на така Ри тяло; LD50 74 мг / кг (зайци, р.о.).
N irrol използван за синтеза на пиролидин и на някои лек. Ср-ин. За първи път е открита Ф. Ф. Рунге през 1834 година в kam.-ug. смола; получен в чиста форма Т. Anderson през 1858 г. в рога и копита суха дестилация.
Литература Общо органичната химия. на. от английски език. Vol. 8, М. 1985, стр. 332-88; Gossauer A. Die Chemie дер пирол, Б. 1974; J такива R. A. бъдеш п G. P. Химията на пироли, N. Y.-L. 1977; Anderson H. J. Loader C. E. "Synthesis", 1985, N 4, стр. 353-64. М. A. Yurovskaya.