Основните видове химични връзки
Твърдо тяло се състои от частици, които, когато достатъчно конвергенция са свързани помежду си сили взаимодействия. Частиците могат да бъдат атоми, йони или молекули. За стабилността на твърда структура на тялото трябва да балансира силите на привличане и отблъскване между частиците. Приемат се разделят комуникация между частиците на твърдите вещества, както следва. Нас Ван дер Ваалс, йонни (полярен), ковалентно. метал и водород.
Те са най-често срещаният тип на комуникация, която съществува във всички съединенията с атомите и молекулите. Те първо са били използвани, за да оправдае уравнение на състоянието на реални газове - на ван дер Ваалс
където определят корекциите, свързани с действието на сили на привличане на / V б 2 и отблъскване между молекули на реален газ. Практически чисти такива сили, възникващи между молекули с наситен химични връзки (О2. Н2. И др.), Както и между атомите на инертни газове в тяхното течно или твърдо състояние. Съобщение Ван дер Ваалс включва три взаимодействия:
Взаимодействието дисперсия. Да разгледаме това взаимодействие може да бъде например два атома на хелий (Фигура 1). В хелий атом разпределението на електронна плътност е сферично симетричен, т.е. Средната електрически момент на атома е нула. В различни периоди, електроните са подредени в определени точки на пространството, създавайки бързо вариращи моментните електрически диполи. Когато две хелиеви атоми в движението на техните електрони установена корелация (съвпадение), което води до силите на взаимодействие. Тези сили могат да бъдат в две посоки. Ако движението на електрони е свързан, както е показано на фигура 1 А, диполи настъпва между миг привличане, което води до комуникационни атома. В случая, показан на Фигура 1 б, атоми са отблъснати. В първо изпълнение (Фигура 1 а) енергия на системата се намалява, обаче, този случай е по-вероятно и това причинява появата на постоянна сила на привличане между атомите на хелий. Тези свързващи сили се наричат дисперсия.
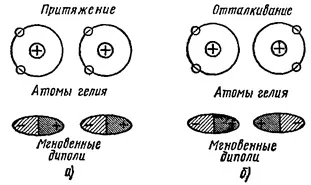
Фигура 1. взаимодействието на дисперсия.
За такъв сила през 1930 г., той е бил произведен за първи път изчислява Лондон. В основата на модел на изчисление се индуцира дипол в атома, която се среща под влиянието на моментната електрически дипол друг атом, което води до реализирането на конфигурацията на фигура 1, както и. Изразът за изчисляване на енергията на дисперсия взаимодействие е равен на:
Ориентировъчна взаимодействие. Когато молекулите имат постоянен диполен момент М, т. Е. Те са полярен, между тях електростатично взаимодействие се появява който се стреми да осигури тези молекули в един подреден начин (Фигура 1.2), тъй като в това положение на енергията на системата намалява.
Ориентация на молекули при ниски температури и максимална обща енергия на взаимодействието се дава от
Когато R - междумолекулярното далечината - диелектрична константа.
За висока температура, както е определено Rees, енергията на взаимодействие на биполярни молекули се определя по формулата
Взаимодействието в наречен ориентация.
Индуктивни взаимодействия. В полярни молекули, които притежават висока поляризуемост могат да възникнат индуцирана (индуцирана) точка под влиянието на полевите постоянни диполи съседни молекули. Debye показа, че енергията привличане между твърдата дипол на първата молекула и втора молекула, индуциран дипол е независим от температура и се определя от отношението
Това взаимодействие се нарича индуциране или деформация.
Когато две молекули обикновено могат да се появят трите вида връзки, и енергията на взаимодействие е съставена от горния енергия
Приносът на всяка част на общата енергия на Ван дер Ваалс връзка, е различен в зависимост от молекулата.
Epifanov GI Физика на твърдото тяло.