Някои алкален - studopediya
Натриев хидроксид, натриев хидроксид - бяло твърдо вещество, хигроскопична и втечняваща обаче; Разтваря се лесно във вода, при което топлината се генерира. Разтвор на натриев хидроксид в сапунена вода на допир и силно корозивна. Той разяжда кожата, тъкани, хартия и други материали. За тази собственост, натриев хидроксид се нарича сода каустик. С натриев хидроксид и неговите решения трябва да се борави внимателно, от страх, че те не попадат върху дрехи, обувки, и още повече, че в ръцете и лицето. На кожата на веществото формира дълго време зарастващи рани. NaOH се използва в сапун решения, кожа и фармацевтичната промишленост.
Концентрацията на калиев хидроксид е бяло твърдо вещество, лесно разтворим във вода, освобождавайки големи количества топлина. Разтвор на калиев хидроксид като натриев хидроксид, mylok на допир и много потребителя. Следователно, калиев хидроксид, също наречен сода поташ. Той се използва като добавка при производството на сапуни, огнеупорни стъкло.
Калциев хидроксид Са (ОН) 2 или гасена вар, - рохкав бял прах, леко разтворим във вода (разтворимост в таблицата с формула Са (ОН) а е буквата М, което означава malorastvorpmoe вещество). Той се получава чрез взаимодействие на негасена вар СаО с вода. Този процес се нарича закаляване. Калциев хидроксид се използва в строителството на зидарията и мазилката на стените, за оправдаят хаотичните дървета за белина, което е дезинфектант. Прозрачен разтвор на калциев хидроксид се нарича вар вода. Когато СО2 се прекарва през вар вода е мътен. Този опит служи за откриване на въглероден диоксид. Реакциите в които разпознават някои химикали, наречени качествени реакции.
За основи също така да съществуват качествени реакция използване алкални разтвори, които могат да бъдат разпознати между субстанции други решения. Тази реакция на основи със специални вещества - индикатори (лат "указатели".). Ако разтвор на алкална добавете няколко капки разтвор на индикатора, а след това ще се промени цвета (раздел. 4).
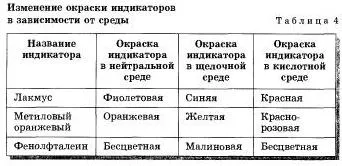
Таблица 4 показва светодиодите и посочена променят цвета си в алкална среда и в кисела среда.
1. основания - са комплексни вещества, съставени от метални йони и хидроксилни йони. Примери на основи с формули: КОН, Mg (OH) 2.
2. Основанията са odnokislotnye и mnogokislotnye. Odnokislotnye - база, във формулите което показва един хидроксиден йон: КОН, NaOH. Mnogokislotnye - база, във формулите които две или повече хидроксилни йони: Са (ОН) 2. 3. Всички база - твърди вещества. Следователно, те не се споделя от състоянието на агрегация и разтворимост във вода. Въз основа на това основата се разделя на две групи - разтворими и неразтворими база. 4. Разтворими (наречени бази). Тези бази образуват метали основна група I група - Li, Na, К, Rb, Cs, FR (тези метали се наричат алкални), както и някои метали основните група II група - Са, Sr, Ba (тези метали се наричат алкалоземен). Всички бази изключение разтвор на амоняк във вода, са твърди материали с различни цветове. Например, калциев хидроксид Са (ОН) 2 е бяло, меден хидроксид, меден (II), Си (ОН) 2 синьо, никел хидроксид (II), Ni (ОН) 2 зелено, железен хидроксид (III), Fe (ОН) 3 червени кафяв цвят, и така нататък. d.Vodny разтвор на амоняк NH3 * Н 2О, за разлика от други бази не съдържа метален катион комплекс и еднократно зарежда амониев катион NH4 и съществува само в разтвор (този разтвор е известен под ви името амоняк). Това лесно се разгражда в амоняк и вода:
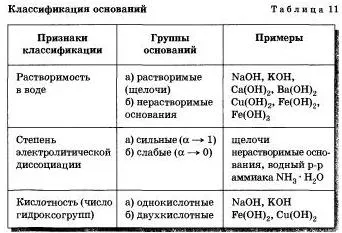
Разделяне основание на групи от различни характеристики са представени в Таблица 11.
Всички база и първата основа (силни електролити) форма при дисоциацията на хидроксидни йони OH-, които са отговорни за редица общи свойства: пенливо допир, индикатори промяна на цвета (лакмус, фенолфталеин и метил оранжево), взаимодействие с други вещества.