Молекулно-кинетичната теория на идеалните газове
Молекулно-кинетичната теория на идеалните газове
Страница 1 от 3
2. Основи на молекулярната физика и термодинамиката
2. Определяне на броя на N атома на един килограм тегло на водород и един водороден атом.

3. В затворен съд капацитет от 20 литра водород, са маса от 6 грама и масов хелий се определя до 12: 1) налягане; 2) моларното теглото на сместа газ в съда, ако температурата на сместа Т = 300 К.

4. Определяне на плътността на смес от водороден газ маса m1 = 8 грама и кислород m2 = 64 гр при температура Т = 290 К и при налягане от 0.1 МРа. Газове считат идеални.

5. В обема на резервоара е 15 литра под азот под налягане от 100 кРа при температура t1 = 27 ° С След освободен от балон 14 грама масата на азот, температурата на газа стане равна на t2 = 17 ° С Определя останалите в цилиндъра налягане на азот.
6. работен обем V = 20 L се състои от смес от водород и азот, при температура 290 К и налягане 1 МРа. Определя се теглото на водород, ако масата на сместа е 150 гр
7. азот тегло седемграма е под налягане р = 0,1 МРа и температура Т1 = 290 К. Тъй изобарно нагряване азот зает обем V2 = 10 л. Определяне на: 1) на обема на газ преди разширяване, 2) температурата на газа след разширяване, 2) плътност на газа преди и след разширение.

8. капацитет съд на 1 л е 1, масата на кислород се определя концентрацията на кислородни молекули в съда.

9. В съд от 5 литра е азот при нормални условия. Определяне на: 1) количеството вещество V; 2) масата на азот; 3) концентрация п от неговите молекули в съда.
10. средноквадратичната скорост на газ при стандартни условия на 480 м / сек. Колко молекули съдържа 1 г от този газ?

11. капацитет съд V = 0.3 L при температура Т = 290 К е известно газ. Как се намалява налягането на газа в съда, ако от него се дължи на изтичане на 19 октомври ще N = молекули.

12. Определяне на натиска, упражняван от газа в стената на съда, ако плътността ρ = 0,01 кг / м3, а средната квадратична скоростта на молекулите на газа е 480 м / сек.

13. Определяне на най-вероятната скорост на газови молекули, чиято плътност е при налягане 40 кРа е 0,35 кг / м3.

14. Определя се средната кинетична енергия (ε0) транслационно движение на молекулите на газа, налягането настройка на 0.1 Pa и с концентрация на молекули 13 октомври cm -3.

15. Определяне на: 1), най-вероятно VB; 2) средно аритметично V; 3) средната квадратична скорост VKV азотни молекули (N2) при 27 ° С
16. На каква температура е средноквадратична скоростта на молекулите на кислорода по-голяма от тяхната най-вероятната скорост 100 m / и?

17. Използване на идеален закона на разпределение на молекулярни скорости на газ, да намерите най-вероятната формула Vc скорост.
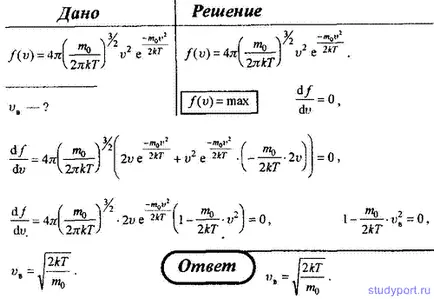
18. Използване на закона на разпределение на молекулите на идеална скорост на газа, намери закона експресиращи разпределението на молекули в относителната скорост U (U = обем / VB).

19. Използване на закона на разпределение на молекулите на идеален скорост на газа, намерете средната аритметична стойност на скоростта V на молекулите.
Забележка: средно аритметично на скоростта се определя от формулата

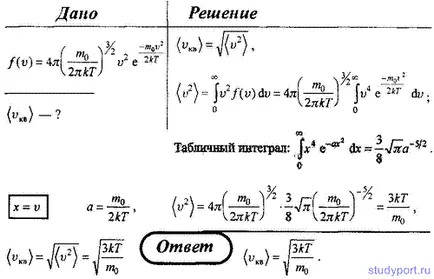
20. Използване на закона на разпределение на молекулите идеална скорост на газа, да средноквадратичната скорост (VKV).
Молекулярна-кинетичната теория на идеалните газове - Страница 2
Страница 2 от 3
21. Използване на функцията за разпределение на молекулите на идеален газ в енергетиката, намери средната кинетична енергия (ε) молекули.

22. Използване на функцията за разпределение на идеална газови молекули в енергетиката, да получите най-вероятната стойност на молекулите на енергия εv.

23. Използване на функцията на разпределение на идеалната газови молекули в енергетиката, се дадена температура съотношението на средната кинетична енергия епсилон молекули на енергия тяхната най-вероятната стойност εv.

24. закон газоразпределителна на скоростта в молекулно светлини на форма F на (V) = Av 3 д -m0v ^ 2. определи: 1), най-вероятната скорост; 2) най-вероятната стойност на енергията на молекули в гредата.

25. На каква височина налягането на въздуха е 60% от налягането на морското равнище? В разтвора се приеме, че температурата на въздуха е същото навсякъде и 10 ° С

26. налягането на въздуха в мината на дълбочина 1 km, ако се приеме, че температурата по цялата постоянна височина и равно до 22 С, и гравитационното ускорение не зависи от височината? Атмосферното налягане на повърхността на земята е равна p0.

27. Определяне на коефициента на въздушно налягане в разгара на 1 км от налягането в долната част на сондажа дълбочината едно километра. Въздухът на повърхността е в нормални условия, а температурата не зависи от височината.

28. На каква височина плътността на въздуха е фактор на д (д - база на натурални логаритми) по-малко в сравнение с нейната плътност на морското равнище? Температура на въздуха и на земното ускорение счита за независим от височината.
29. Използване на идея Perrin инсталацията за определяне на константата на Авогадро и прилагане на боя частици, суспендирани във вода, разпределението на Болцман, се обемът на частиците, ако разстоянието между двата слоя 80 микрона брой на суспендирани частици в един слой два пъти повече от другата. Плътността на разтваря багрило 1700 кг / м 3 и температурата на околната среда от 300 К.

30. Определя се средната свободен път л кислородни молекули при температура 0 ° С, ако Z е известно среден брой сблъсъци опит за една молекула с равен 3,7 х 10 9.

31. В това, което налягане средният свободен пътя на молекули на водород е 2,5 см, когато температурата на газа е 67 ° С? Диаметър водородни молекули считат равни на 0.28 пМ.

32. определя средната дължина свободни път τ водородни молекули при температура от 27 ° С и налягане от 0,5 кРа, като диаметърът на молекулата на водород от 0.28 пМ.

33. Средната свободен път дължина L1 на водородни молекули, при нормални условия е 0.1 микрона. Определя се средната дължина на средната свободен път при налягане от 0.1 МРа се получава, ако температурата на газа остава постоянна.

34. При температура 300К и налягане средният свободен път л кислородни молекули е 0.1 микрона. Какво е средният брой на колизии, изпитвани от молекули на 1, ако плавателният съд се евакуира до първоначално налягане от 0,1? Температурата на газовата приема да бъде постоянна.

35. Определяне на: 1) р плътност на въздух в съда; 2) п концентрация на молекулите; 3) средното свободна дължина на пътя (L) на молекулите, ако съдът се вакуумира до налягане 0.13 Ра. Диаметърът на въздушните молекули вземе равен 0.27 пМ. Температура на въздуха 300 К.

36. Определя Коефициент на топлопроводимост λ на азот в определен обем при температура 280 К. ефективния диаметър на азотните молекули е 0.38 пМ.

37. Кислородът е при нормални условия. Определя Коефициент на топлопроводимост λ от кислород, ако ефективния диаметър на молекулите му е 0.36 пМ.
38. Пространството между две успоредни плочи от 150 cm 2 на всеки, разположени на разстояние от 5 mm един от друг, изпълнени с кислород. Една плоча се поддържа при температура от 17 ° С, а от друга - при 27 ° С Определяне на количеството топлина, която е преминала в продължение на 5 минути с проводимост от една плоча с другия. Кислородът е при нормални условия. Ефективният диаметър на кислородни молекули считат равна на 0.36 пМ.

39. Определяне на D коефициента на дифузия на кислород при нормални условия. Ефективният диаметър на кислородни молекули приема равна на 0.36 пМ.

40. Определяне на масата на азот преминава през разследването на площта за дифузия на 50 cm 2 за 20 сек, ако градиента на плътност в посока, перпендикулярна на сайта е 1 кг / м 4. температурата е 290 К и средният свободен пътя на молекули е равно на 1 цт.

41. Определяне на броя на различни коефициенти на динамичен вискозитет η на въглероден диоксид и азот, когато и двете са под същата температура и налягане. Ефективните диаметри на молекули на тези газове са равни.

42. Определяне на топлопроводимост от азот, ако динамичен вискозитет за това, при същите условия е 10 иРА * С.

43. Азотът е при налягане от 100 кРа при температура от 290 К. определяне на коефициент на дифузия D и вътрешно триене ц от. Ефективният диаметър на азотните молекули взети равно 0.38 пМ.
44. По-долу, някои налягане може да се говори за вакуум между стените на Dewar, ако разстоянието между стените на съда е 8 mm, температура 17 ° С, ефективния диаметър на въздушните молекули е 0.27 пМ.

45. Налягането на газа в разреден рентгенова тръба при температура от 17 ° С е 130 иРА. Дали това е възможно да се говори за висок вакуум ако характеристика размера на L0 (разстояние между катода и анода на тръбата) е 50 mm? Ефективният диаметър на въздушните молекули вземе равен 0.27 пМ.
