метод за получаване на кумол фенол
към списъка на лекции
към списъка с артикули
метод за получаване на кумол фенол.
Фенол С6 Н5 ОН е кристално вещество (т т.т. = 42 0 ° С, под обратен хладник т = 181,4 0 ° С) в прясно дестилиран форма е безцветен. Но съхранението става дълбоко оранжево или червено.
Основни направления на прилагането му - производството на фенолни смоли, синтетични влакна, найлон и найлон, епоксидни смоли и поликарбонати. Тя се използва като междинно съединение при производството на бои, наркотици и експлозиви, хербициди. фенол получава чрез алкилиране на антиоксидантни добавки и междинни съединения за синтеза на нейонни повърхностно активни вещества.
Най-напредналите метод за производство на фенол, кумол се основава на изпълнението на следните етапи:
1. Окисляването на изопропилбензол (кумен) хидропероксид
2. Разширяване на получената хидропероксид на фенол и ацетон
Обобщаващо уравнения (1) и (2) се получават уравнението на процеса на получения
Може да се види, че дясната страна на общата сума на (3) включва само фенол и ацетон, които са ценни търговски продукти. От друга страна, в този процес изисква евтини и достъпни суровини (изопропилбензол и въздух). Това прави процеса на кумол за получаване на най-икономичния сред всички известни методи за получаване на фенол.
Да разгледаме основните стъпки модели на потока на окисляване и разлагане на изопропилбензол хидропероксид.
Окислението на изопропилбензол (кумен)
Окислението на изопропилбензол е типичен процес на свободни радикали с дегенеративен верига разклонения. В отсъствието на външни агенти изходните зародиши вериги извършва чрез взаимодействие на бимолекулярен кислородни молекули и изопропилбензол
Тази реакция се характеризира с висока енергийна бариера и е бавен. Ниската степен на започване не може да осигури концентрацията на свободни радикали при ниво, което предизвиква значително процес изтичане верига.
Тъй изопропилбензол хидропероксид разлага лесно в слаба кислород-кислород връзка,
натрупването му в процеса води до увеличаване на скоростта лавина генериране на свободни радикали, и следователно скоростта на окисление на изопропилбензол. Такъв характер на процеса води до присъствието на определен период индуциране на реакцията, което се определя като времето, през което системата се натрупва хидропероксид осигурява значително процес изтичане верига. В тази връзка, по естествен начин да се намали периода индукция е да се добави известно количество от изходния изопропилбензол хидропероксид или окислен реакционната маса.
индукционният период на процеса може да бъде значително по-дълго поради наличието в реакционната маса на инхибитори на свободни радикали окисляване като сяра-съдържащи органични съединения, феноли и т.н. В този случай, индукционният период се определя като времето, през което системата е разрушен инхибитор J -. Н поради взаимодействие с верижни радикали
R х + J - H ® RH + J х
По този начин формират радикали J × неактивни и не могат да продължат по-нататък по веригата. Поради причини значително нарастване на индукционния период важен технологичен проблем е почистване на суровината от вещества, които са инхибитори или способно да даде на инхибитори на окисляването.
(. манганови соли, кобалтови и т.н.) Конвенционалните течна фаза окислителни катализатори в този случай не може да се използват като агенти за откриване, тъй като те vyzyvaeyut значително разлагане на хидропероксид в страничен продукт - диметилфенилкарбинола.
Процесът на окисление на изопропилбензол хидропероксид в сложна образуване на странични продукти: ацетофенон и диметилфенилкарбинол. основните и нежелани реакции могат да бъдат предвидени по следната схема
В съответствие със схемата, представена диференциално селективност на хидропероксид в процеса изразена чрез уравнението
В условия на стабилно състояние
обаче, тъй като специфичното тегло на ацетофенон в този процес е малък, член 2 R в последния уравнение може да бъде игнориран
Тогава съотношението на концентрациите изразена чрез уравнението
Заместването на последния израз в уравнението (4), ние имаме най-накрая
Анализ на това уравнение показва, че реакционната селективност намалява с намаляване на парциално налягане на кислорода и увеличаване на степента на превръщане (който съответства на натрупването на хидропероксид и намаляване на концентрацията на въглеводороди). В съответствие с ниска енергия на реакции за активиране на основните вериги на процеса на сравняване с страна Е4> E 1 и Е 2> E 3, селективността на процеса се увеличава с намаляване на температурата, но това намалява неговата скорост. Това го прави необходимо да се избере оптималната температура. На практика методът се провежда при температури от 105-120 ° С Ако процесът се провежда в каскада реактор, температурата на процеса се понижава постепенно при прехода от един реактор в друга. Такова решение позволява, като същевременно се запази скоростта на процес (с увеличаване на концентрацията на хидропероксид) увеличаване на селективността на процеса.
Увеличаването на налягането води до увеличаване на скоростта и селективността на процеса. В същото време налягането се ограничава от по-горе във връзка с по-строги условия на оборудването, увеличение на разходите за компресия газ експлозивен граници разширяване на пара-газова смес през реакционната маса. На практика, работещи с налягане от 0.3-0.5 МРа.
Времето на реакцията се определя чрез оптимално превръщане. Повишена превръщане (съответстващи на изтощение и натрупване ROOH RH) води в съответствие с уравнение (5) за намаляване на селективността.
Намалена превръщане изгодно от гледна точка на селективност на води до увеличаване на дела на нереагирал изопропилбензол, което изисква допълнителни разходи за рециклиране. Оптимално превръщане, което представлява компромис между изискванията на висока селективност и икономично рециклиране обикновено е 25-30%. Тези стойности съответстват на реакционното време превръщане на няколко часа.
Поради високата реактивност на процес изопропилбензол при определени условия може да възникне в региона на дифузия. В този случай, ниска концентрация на кислород в реакционната маса съгласно уравнението (5) определя намаляването на селективността на процеса. Затова важен технологичен проблем в процеса на изпълнение е създаването на ефективна хидродинамичен режим.
Този проблем се решава чрез създаване на режим на реакционната маса циркулация чрез провеждане на метод на високоефективна апарат масообмен.
Наличието на киселинни примеси в реакционната маса на процеса предизвиква нежелано разлагане на хидропероксид на фенол, който е инхибитор на процеса на свободни радикали окисляване:
С цел да се неутрализира генерира киселина по време на процеса на примеси, например, чрез взаимодействие:
процес izoprpilbenzola окисляване често се извършва в присъствието на алкални агенти. Тъй като последният се използва BACO 3. СаСОз 3. Na 2 СО 3. натриев бикарбонат 2 и др.
Разлагане на хидропероксид на фенол и ацетон.
Разлагането на изопропилбензол хидропероксид се катализира от протонни киселини. Реакцията протича чрез йонен механизъм:
Получената катион прегрупиране с миграцията на групата енол с кислородния атом и следващите реализации, в резултат на фенол и ацетон се получава:
Окислителни странични продукти, съдържащи като примеси в хидропероксид, също така може да влезе в различни реакции под въздействието на киселинни катализатори. Така диметилфенилкарбинола се дехидратира до получаване на-метилстирен, а също действа като алкилиращ агент по отношение на фенол. В допълнение, метилстирен димеризира:
Получават се малко количество смола по-сложна структура. С увеличаване на концентрацията на киселина и температура са възможни киселина каталитично преобразуване на ацетон и ацетофенон, например, кондензация тип aldolnoy последвано от отстраняване на вода:
основния скоростта на реакцията е описан от уравнението:
Реакцията протича много бързо. В присъствието на 0,05-0,1% (тегл.) H 2 SO 4 при 50-60 0 ° С се постига почти пълно превръщане след 2-3 минути.
Поради високата скорост на процес, когато промишленото прилагане е необходимо, че стойността му не е достигнат, при който топлината не може да бъде отстранен, за да премахване на топлинните контролира процесите, реакцията се извършва в разредители, които служат като реакционни продукти и ацетон.
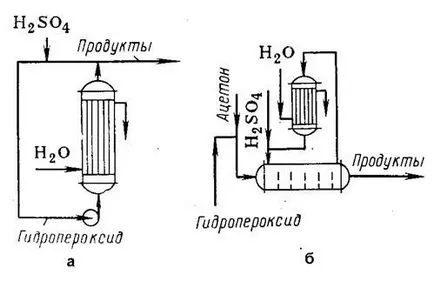
Фиг. 1. Реакционните компоненти за киселина разлагане на хидропероксид:
и - поток циркулационни системи;
б - инсталирането на топлинно vodom поради изпаряване на ацетон-ТА.
Един метод за прилагане на реакцията е стар поток циркулация инсталация (р UC. 1а), когато vyde-, регулиращи топлинно отстранява в тръбен реактор от охлаждане Denia с вода. Реакционната смес напуска реактора е частично изтеглен за по-нататъшна обработка, но основния съвместно lichestvo се рециклира: се добавя киселина катализатор и помпата се смесва с изходен хидроперокси-къщата. В такава система, времето за контакт е ограничен и разсейване на топлината е напълнен. В допълнение, рециклиране на смес води до повишаване на добива на нежелани вещества. По този начин, на 1 тон фенол се получава от 100-150 кг на отпадъци, включително и 15 до 20 кг а-метилстирен, 40-50 кг димер и катран, 5-10 кг ацетофенон, кумилфенол и 30 килограма т. D. Въпреки че се образува мезитилоксид не-много, но го прави трудно лечение фенол.
Друг метод за разлагане на киселина хидропероксиди (фиг. 1b) е реакцията да се провежда в отстраняване ацетонов разтвор и топлина поради изпаряване. Ацетон се кондензира в кондензатора на обратен хладник и се връща в реактора, който може да бъде разделен от напречни прегради. Това, заедно с намаляване на концентрацията на фенол в разтвора и време на контакт намалява добива на странични продукти.
Диаграма за производство на фенол и ацетон метод кумол.
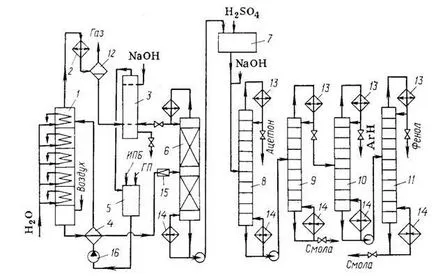
Фиг. 2. Flow метод диаграма кумол за получаване на фенол и ацетон:
1 - колона реакция; 2 - хладилник; Z - миене сепаратор; 4 - teploob-топлообменник; 5 - събиране; 6, 8-11 - отстраняване колона; 7 - монтаж на киселина пъти Предложение хидропероксид на; 12 - сепаратор; 13 - dephlegmators; 14 - бойлери; 15 - разширяване клапан; 16 - помпа.
фенол и ацетон производство от етапа на производство на кумол включва изопропилбензол, хидро-изопропилбензол синтез пероксид и киселина разлагане на фенол и ацетон.
Технологична схема на последните два етапа е показана на фиг. 2. Реакцията на окисляване се провежда в колона тарелка (19), снабдена с: на под грижите-Hered течност температура от 120 ° С в горната плоча до 105 ° С в куба. Air предварително пречистен чрез zagryaz neny и твърди вещества и предварително нагрят, се подава в долната част на колона nyuyu налягане "0,4 МРА. Прясна и за фирма командващ-изопропилбензол (SPI), към която хидропероксид (SE), който инициира началния етап на окисляване на контейнера (5) се подава към топлообменника (4) и от там на горната плоча на реактора. Въздухът се движи в противоток на течността чрез прокарване през него на тавите за колоните. Така uvle-кае с двойка изопропилбензол и летливи странични про дукти (мравчена киселина, формалдехид), който Kondo siruyutsya в хладилник (2). Останалата въздух се извежда към най-mosferu и кондензатът се промива от мравчена киселина воден алкален в сепаратор скрубер (3). въглеводород-ти слой се отделя в сборник (5) и водният слой се рециклира в измиване, в крайна сметка отпадане на канала.
Окислявам от дъното на колоната (7) съдържа до 30% употреба-roperoksida. Тя дава своята топлина в изопропилбензол топлообменник (4), се дроселира до остатъчно налягане "4 кРа и се подава вакуум дестилация, за да се концентрира хидропероксид. Изопропилбензол дестилация се извършва в опаковани дестилационна колона (6) е непрекъсната, снабдена със солна-кондензатор-dephlegmator. Прилагане на вакуум Obus погледа термична нестабилност хидропероксид. Част от кондензирано изопропилбензол се рециклира от кондензатор-dephlegmator тор-напояване на колоната (6), и почести останалите Coli изведени на сепаратора (3), промива се с алкален и отново се подава към окисление. Дъна течни от колона (6) с стопанство-70-75% от хидропероксид и окислителни странични продукти и остатъци изопропилбензол. Чрез по-нататъшно вакуумна дестилация (не е показана на фигурата) под остатъчно налягане-префектура "665 Ра увеличи концентрация gidroperok-Sida до 88-92%. Следващата стъпка (киселина разлагане на хидропероксид) се извършва при възел (7) описват два шейна горните методи.
Последната стъпка е дестилация, която се извършва в различна последователност. В повечето случаи, първият при нормално налягане в колона (8), ацетонът се отдестилира, след това при понижено налягане се отделя в колона (9) на сместа от вещества с високо точка на кипене (фенолна смола), останали в куба, от повече летливи продукти, включително фенол. От тази част на колоната (10) се отдестилира и след метилстирен остатъци изопропилбензол (въглеводородна фракция) и в колоната (11) - фенол, оставете кубчета допълнително фенолна смола.
При някои инсталации, въглеводородната фракция хидро ruyut и се връща към окисление. Това пречи на инхибиращия ефект на а-метилстирен и не позволява кон-центрирана хидропероксид за разлагане или продължи само "укрепване". Редица методи за рециклиране на фенол смола, включително пиролиза за получаване на допълнителни количества от фенол-ТА.
към списъка с артикули
към списъка на лекции