критична точка
Както следва от P-фаза Vdiagrammy (фиг.3.3) за увеличаване на разлика в налягането между специфичния обем на течността на кипене (V) и сух наситен пара (V ") постепенно намалява и в точка К става нула. Това състояние се нарича критична точка К и - най-критичната точка на дадено вещество.
PF, Tf, VR, SK - критични термодинамични параметри на материята.
Например, за вода:
Vk = 0, 00326 m 3 / кг
В критичната точка свойства на течни и газообразни фази са идентични.
Както следва от фазата Т - Sdiagrammy (фигура 3.4) в критична точка топлина на изпарение, изобразен като площта под хоризонталната линия на прехода от фаза (С "- С" '), от кипяща течност на сух наситен пара. нула.
Точка К изотермите за Tc-в fazovoyP Vdiagramme (фиг.3.3) е инфлексна точка.
Изотерма Tk. минаваща през точка К, yavlyaetsyapredelnoy изотерма фаза областта, т.е. отделя течната фаза от газообразен регион.
При температури над Тс изотермите нямат никакви прави части, показателни за преходи фаза, нито инфлексна точка характеристика на изотерма Tk. и постепенно да бъде под формата на меки линии, подобни по форма на идеални изотермите на газ.
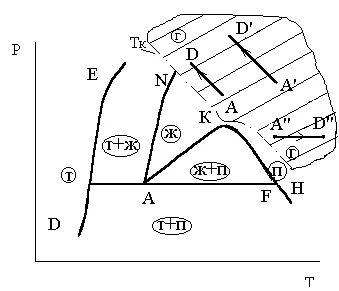
Термините "течни" и "газ" (пара) до известна степен произволно, тъй взаимодействието на молекулите в течността и газа са общи модели, различаващи се само количествено. Тази теза се илюстрира risunkom3.6 където преходът от точка Д до точката на газовата фаза от течната фаза L се произвежда в критична точка К на EFL траектория.

Фигура 3.6. Два варианта на фазовия преход
от газообразните към течната фаза
При преминаване през точката С Adv вещество се разделя на две фази и след това постепенно се променя вещества от газова фаза (пара) към течността.
В точка С на свойствата на материала променят рязко (в P-фаза Vdiagramme точка С на прехода фаза на прехода фаза се превръща в зона (С "- С")).
При преминаване през газ в течната EFLprevraschenie настъпва непрекъснато, тъй като кривата не се пресичат liniyaEFLnigde изпаряване TC, където веществото едновременно съществуват в две фази, течност и пари. Ето защо, когато щракнете върху liniiEFLveschestvo няма да се разделят на два етапа и остава еднофазен.
Критичната температура Tc - е ограничение на температурата на равновесие съвместното съществуване на две фази.
С позоваване на термодинамичните процеси в сложни системи е класически кратко Tc определянето може да бъде използвана, както следва:
Критичната температура Tc - е по-ниска температура гранична област на термодинамични процеси, при които наличието на двуфазна състояние е невъзможно вещество "газ - течност" при никакви промени в налягането и температурата. Това определение е илюстрирана на Фигура 3.7 и 3.8. От тези цифри следва, че зоната, ограничена от критична температура, покрива само газообразно състояние на материята (газова фаза). Газообразно състояние на материята, наречена пара в тази област не е включена.
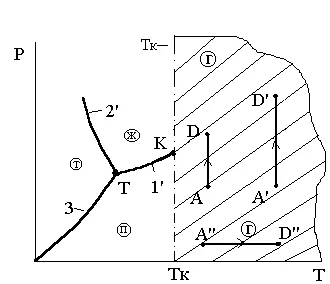
Фиг. 3.7. По дефиниция, критичната определяне на критичната Ris.3.8.K
ТА температура Температура
От тези цифри следва, че сенчестата зона, ограничена от критична температура, покрива само газообразно състояние на материята (газова фаза). Газообразно състояние на материята, наречена пара в тази област не е включена.
Използването на концепцията за критичната точка, е възможно от общата концепция за "газообразна материя" подчертават концепцията за "пара".
Pr - фаза вещество в газообразно състояние в региона под критичната температура.
В термодинамичен процес, когато технологичната линия или крива пресича TC изпаряване, сублимация или кривата 3, е винаги първата газова фаза е водна пара.
Критичното налягане Pk - е налягането над която разделяне на две вещества едновременно съществуват заедно в равновесни фази: течност и газ не може да бъде при всяка температура.
Това е класическото понятие Пк. по отношение на термодинамични процеси в сложни системи могат да бъдат формулирани по-подробно:
Критичното налягане Pk - е на дъното на границата на налягането на термодинамичните процеси, при които наличието на двуфазна състояние е невъзможно вещество "газ - течност" при никакви промени в налягането и температурата. Това определение илюстрира критичен ris.3.9 под налягане. и 3.10. От тези цифри следва, че зоната, ограничена от критичното налягане, не само обхваща част от газовата фаза, намиращ се над ПК isobars. но също част от течната фаза под изотерма Tk.
За суперкритичен регион за вероятност (условно) граница "течност-газ" условно приеме критична изотерма.
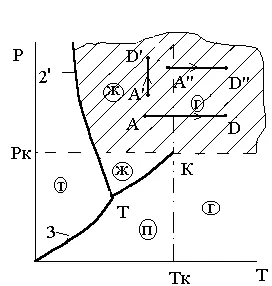
дефиниция Ris.3.9.K критичните точки - Ris.3.10. Определяне на критичните
Кой налягане
Ако налягането на прехода е по-голямо от налягането в критичната точка, съдържанието на твърдо вещество (кристален) състояние ще премине директно в газообразно състояние, без да става чрез течно състояние.
От Р-Т фазова диаграма аномален вещество (фигура 3.6, 3.7, 3.9), не е очевидно, защото те не са показани страна на диаграмата, където веществото с високо налягане в няколко кристални модификации (и следователно повече тройни точки) отново поема нормални свойства.
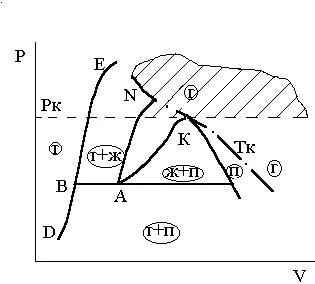
На фаза P - T диаграма нормални вещества Фиг. 3.11 прехода от твърдата фаза в газообразните веднага показан като A'D процес.
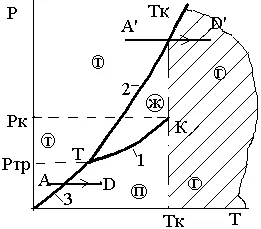
Фиг. 3.11. преход на нормална
вещества от твърдата фаза директно в
газообразно при P> FFR
Преходът от твърда фаза на пара, заобикаляйки течността, се дава само когато R<Ртр. Примером такого перехода, называемого сублимацией, является процесс АDна рис 3.11.
Критичната температура е много проста молекулно - кинетичната тълкуване.
Комбинации на свободно движещи се молекули в капка течност при втечняване на газ се появява само под въздействието на взаимно привличане сили. Когато Т> Тс кинетичната енергия на относителното движение на двете молекули имат повече енергия привличане на тези молекули, така че формирането на течни капчици (т.е. съвместното съществуване на двете фази) е невъзможно.
Критичните точки са само за изпаряване на криви, като те съответстват на равновесие съвместното съществуване на две фази, изотропни течност и пари. топене и сублимация линии са критични точки, като те съответстват като двуфазна състояние на веществото, където една от фазите (твърдо вещество) yavlyaetsyaanizotropnoy.
