Механизми на свободни радикални реакции на заместване
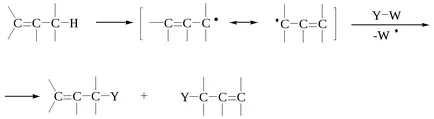
Реакцията на заместване на свободен R-X R-Y на първия етап трябва да бъде разцепване на субстрата R-X, за да образуват радикал R . което може да се направи по два начина:
където W - инициатор.
Obazom радикал R може да премине в продукта по два начина:
В реакции с най на продукта означава дължина на веригата, образувана от отделянето (а), а не чрез рекомбинация (д). тип Етап rasshepleniya (а) означават SH 1 и етап (б) и (в) престои SH 2. Реакциите могат да бъдат класифицирани като SH SH 1 или 2, въз основа на това дали RX R превръща в пътя на (а) или пътека (б).
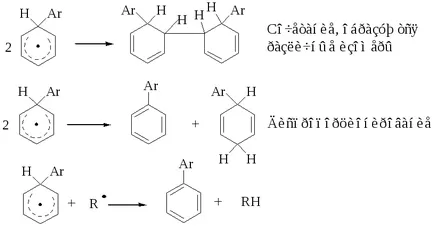
Механизми реакции с ароматни субстрати
В реакциите, общата схема, от които:
не е проста схема разделяне протон:
Обучение биарили описват механизъм включва образуването на междинно съединение стабилизиран резонанс:
Междинно съединение относително стабилен и реакцията се прекратява по три начина:
Участие в съседни групи от свободни радикали реакции
Доказано е, че в някои случаи етапът на разцепване и етапа на разделяне се ускоряват в присъствието на съседните групи. Фотолитично халогениране обикновено води до смес на продукта, обаче, бромирането на въглеродната верига като бромен атом вече настъпва с висока региоселективност. Когато бромиране на алкилбромиди заместването се извършва в съседна позиция с бром от 85-95%.
Необичайно висока региоселективност се обяснява по следния предполагаем механизъм:
Обикновено Br разделя водороден радикал от R-H, давайки радикал R . Ако подходяща позиция на молекулата е вече наличен атом Br, насърчава процеса на разделяне, образувайки циклична междинно съединение. В последния етап от цикъла е счупен. Ако този механизъм е вярна, тогава конфигурацията на въглероден атом трябва да бъдат спасени, че действително е наблюдавано. Промотиращ ефект на съседни групи, намерени в други радикал смяна.
Реактивност в радикал смяна
Етапът на верижна реакция, която определя кои продукт трябва да се формира, често е етап на разделяне. Под действието на радикал никога Самостоятелна три- или четиривалентен атом, с изключение на реакции, включващи интензивни системи, и рядко се откачи двувалентен атом. Като правило, има отделяне на моновалентен атом. Обикновено това е протон или халоген. Например, в реакцията на етан с радикал Cl формира не водороден атом и етилов радикал
Основната причина - на етерични. Моновалентно атом е много по-отворен за атака входящо радикал от многовалентен атом. Друга причина е, че в много случаи разликата моновалентен атом е енергетично по-благоприятна.
Алкани. На алкани по почти всички радикали предимно извън третичен водороден атом, тогава вторичната. Степента на предпочитание зависи от радикал селективността и температурата.
Ефект на селективност може да се счита например радикали и F Br. в първичното и вторичното позицията на първия съотношението на заместване е 1. 1,4, и за по-малко реактивен Br - 1. 16000.
Естеството на селективност може да варира, ако наложено от пространствени фактори. Например, фотохимично хлориране на изопентан в сярна киселина под действието на N-хлоро-ди-трет-бутиламино и N-хлор-трет-бутил-трет -pentilamina първичен протон разделя 1.7 пъти по-бързо третичен. В този случай, йон-радикал, R2 + N H е достатъчно голям, за да се създаде пространствена пречка.
Олефини. При лечение с хлорни или бромни субстрати, съдържащи множествена връзка обикновено се случва подмяна и закрепване.
В случай, че има отделяне на протон, почти никога не се наблюдава разделяне на винил водородни атоми, докато алил протона от много по-лесно, отколкото в други части на молекулата. В тези случаи е налице алил пренареждане.
Алкиларил. странична верига грешка се появява предимно в -позиция спрямо пръстена. Същата позиция е атакувана от активни и по-селективни радикали.
Съединения, съдържащи електрон-привличащи групи. Когато халогениране значително електрон-привличащи групи деактивират съседния позиция. Така, съединения от типа Z-СН2 -СН3 подложени единствено или предимно за атака -позиция. Съединения като СН3 СООН, не влизат в радикал заместване, за разлика от електрофилно, където заместването е за предпочитане в -позиция. Това се обяснява със следните фактори. Както е известно, частици със неразделен електронна двойка, имат по-нуклеофилни свойства, частици, имащи свободни орбитален на ниска енергия, - електрофили. Радикалите могат също да притежават нуклеофилни или електрофилни свойства в зависимост от свойствата на електрон-атом, носещи несдвоен електрон. Халогени са електрофилно радикали и търси позиция с висока електронна плътност. Алкиловите радикали са, напротив, имат нуклеофилни свойства и са способни да абстрахиране протон от намалена плътност електрон.
Пример. Заместването на пропионова киселина
показва, че метилови атаки повече -позиция и Cl - -позиция.
Ароматни субстрати. Безплатна радикал заместване на ароматни субстрати рядко протича през механизма за разделяне водород:
Обикновено полученото междинно съединение:
Ефектът на различни фактори на реактивността на ароматни субстрати
1. Всички заместители увеличи реактивоспособността на орто - и пара позиция спрямо бензен, независимо от това дали те са електрон-отдаваща или електрон-отнемане.
2. Реактивност в мета-позиция не зависи от естеството на заместителя и е в близост до реакцията на бензен способност.
3. Реактивност в орто-позиция обикновено по-висока от пара - с изключение на много обемисти групи.
4. По отношение на пряката конкуренция отделящи електрони групи имат по-голямо въздействие, отколкото на електрона.
5. Ефект на заместителите е много по-малък от реакциите SN и SE.
Влияние на характера на атакуващият на реактивността на радикала
Радикалите се различават по тяхната реактивност. В този случай по-малко реактивен селективен, по-малко реактивен и по-селективни. Всички радикали обикновено неутрален, но те притежават различна степен електрофилни или нуклеофилни свойства.
Влияние на характера на разтворителя на реактивността на
Rasvoritel обикновено има малък ефект върху реакцията свободни радикали заместване, за разлика от йонни реакции. Въпреки това, в някои случаи, разтворителят може да има забележим ефект.
Тези резултати се дължат на образуването на комплекс между разтворителя и хлорен атом
като Cl по-малко реактивен и следователно по-селективни.