Кръгови процеси (цикли)
Процесът, чрез който системата, преминавайки през поредица от държави, се връща в първоначалното си състояние се нарича кръгова или процес цикъл. схема, изобразена процес цикъл е затворен (Фигура 7) на кривата.
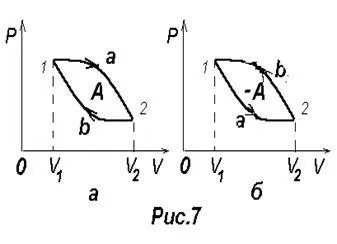
Цикълът може да бъде разделена в процеса на разширяване и свиване 1-2 2-1. Работа разширяване на които се определя от площта на фигура 1 1a2V2 V1 е положителен, тъй DV> 0. работа компресия, която се определя от площта на фигура 2 2b1V1 V2 е отрицателен, тъй DV <0. Следовательно, работа, совершаемая газом за цикл определяется площадью,
обхванат от затворена крива.
Ако цикълът на положителна работа (постъпления цикъл в посока на часовниковата стрелка), тя се нарича директен (Фигура 7, A). Ако цикъла на отрицателна работа, извършена (постъпления цикъл обратно на часовниковата стрелка), той се нарича обратна (Фигура 7 б). В случай на обратен цикъл външен орган изпълнява положителна работа по газ - работата компресия на ¢ на газ. Газът в този случай, прави негативни работа A = -A ¢.
Директен цикъл се използва в термални двигатели - периодично, работещи двигатели ангажират операция по получаване на топлина от външната страна.
Обратен цикъл, използвани в хладилници - периодично действащи инсталации, в които поради операция на външни сили, топлината се предава на тялото при по-висока температура.
В резултат на това на кръгла процес, системата се връща в изходно положение, а оттам и общото изменение на вътрешната енергия на DU нулев газ. Следователно, PNT (4) за цикличен процес: Q = DU + A = А. т.е. работа за един цикъл е равен на количеството топлина, получена от външната страна. Въпреки това, в резултат на процеса на кръгъл топлинен двигател как да се получи и да следователно А = Q1 -Q2. където Q1 - количество топлина, получена от системата, Q2 по - kolichetvo топлина дадена система. съотношение ефективност за цикличен процес
Термодинамични процес, наречен обратим, ако тя може да се случи както в права и обратна посока и по този начин системата се връща към първоначалното състояние и в околната среда и в тази система няма промяна. Например, ненамален вибрации. Имайте предвид, че равновесните процеси се наричат също обратими.
Всеки процес, който не отговаря на тези условия, се нарича необратим. (Имайте предвид, че всички процеси, придружени от триене, са необратими).
цикъл на Карно е изобразена на фигура 8, където изотермично разширяване и компресия са дадени от криви 1-2 и 3-4, за адиабатно разширяване и свиване - кривите 2-3 и 4-1.
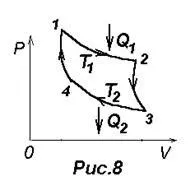
Според (23) на ефективността на цикъл на Карно, Н = А / В = (Q1 -Q2) / Q1 = 1- Q2 / Q1. където Q1 - количество топлинна енергия, произведена от нагревателя газ, температура Т1. Q2 - kolichetvo топлина даден газ охладител, температура Т2. Карно показва, че за този цикъл е Н = (Q1 -Q2) / Q1 = (Т1-Т2) / T1 = 1, T2 / T1. (24), т.е. Ефективността се определя само от нагревател и хладилни температури. Карно Предполага се, че този резултат е валиден за всички термодинамични системи.
Обратен цикъл на Карно е в основата на действието на топлинни помпи. Термопомпите се нуждаят най-много топлинна енергия, колкото е възможно да се получи страхотно тяло, като отоплителната система. Повечето от тази енергия се взема от околната среда на ниска температура и долна част - се получава чрез механична обработка, произведени, например компресор.
4.10.1. Ентропия в термодинамиката
При изучаването на PNT () отбележи. че Du е общо диференциално (известен от математика че Du разлика е пълно, ако интеграл е независимо от пътя на интеграция, и по-специално, на интеграл по затворен път или линия L = 0) и DQ Da и разликите не са пълни.
От математиката е известно също, че сумата, с която е необходимо да се умножи израз, за да го направи пълен диференциал, се нарича интегриращ фактор. В термодинамиката, е доказано, че за обратим процес като интегриращ фактор е 1 / T и когато DQ / T ще бъде общата разлика от някои все още неизвестни за нас състояние на системата функция S, т.е. DQ / T = DS. (25)
Така определената състояние функция S термодинамична ентропията на повикването система, тя се измерва в J / К. От (25) се вижда, че ДС и DQ са със същия знак. Това ви позволява да променя характера на ентропия да съди ръководството на процеса на пренос на топлина. Концепцията за ентропия е въведена през 1865 г. от Клаузиус.
POT (8) за идеален газ произволна маса m с формула U = (I / 2) NRT = NCV Т. CV = (I / 2) R, PV = NRT (п = m / M - броя молове) и е под формата пълен диференциал ентропия
Тъй като идеален газ PV на постоянно тегло / T = конст. на
LNP + LNV -lnT = конст. и г LNP + г LNV -d LNT = 0 и уравнение (26) може да се запише в двете еквивалентни форми него
Ако системата се движи от състояние 1, характеризиращ се с Р1 параметри. V1. T1. в състояние 2, характеризиращ се с Р2 параметри. V2. T2. според промяната на ентропията (26) - (28) DS = S2 -S1 = = N [CV LN (T2 / T1) + R LN (V2 / V1)] =
т.е. наистина DS = DQ / Т е общото състояние диференциална функция S - ентропия.
Тъй като за адиабатен процес DQ = TDS = 0. след това, следователно, DS = 0 и S = конст. По този начин, обратим адиабатен процес е изоентропен процес.
Формули (26) - (29) дават възможност за изграждане на термодинамичен диаграма T-S. Вж. Фигура 9. Нека точка O представлява първоначалното състояние на идеален газ, а след това
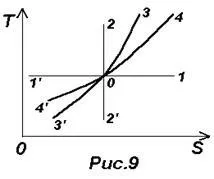
Изобарен процес изобразен линия 4-4 ¢. простираща се постави isochore ¢ 3-3 (0-4 - отопление и разширение, 0-4 ¢ - охлаждане и компресия).
По този начин, ентропията S може да се счита като точно същият параметър като три друг параметър P, V, T. Само като идеален газ уравнение на състоянието PV = NRT възможно да се изрази, например Т чрез други параметри P и V. и експресията ( 29) дава възможност да се изрази S чрез други системни параметри P. V и Т.
4.10.2. Ентропията на кинетична гледна точка. Третият закон на термодинамиката
Ентропия термодинамична въведена тук, се използва успешно в изчисленията в термодинамиката.
Когато течността се втвърдява, молекулите в кристалната заемат точно определена позиция един спрямо друг, така че заболяването намалява рязко. Съответно, топлина освобождава по време на втвърдяването и ентропията намалява рязко. В абсолютната нула топлинна движението спира напълно, като по този начин неправилност също е нула. В тази връзка, ентропията на всички вещества, при Т = 0 се приема равна на нула.
Приемане: ентропията на всички органи в равновесие клони към нула, тъй като температурата доближава нула Келвин, т.е. нарича третия закон на термодинамиката или теорема на Нернст-Планк (1906, 1910).
Ентропията като мярка за разстройство в система добре описва зависимостта си не само от температурата, но и от размера и други параметри на системата.
4.10.3. Ентропия в равновесие статистическа физика
По-дълбокият смисъл на ентропията се разкрива в статистическия физика: ентропията, свързани с термодинамична вероятността за състоянието на системата. термодинамична вероятност W система състоянието на - е броят на начините, по които могат да бъдат приложени дадено състояние на системата или на броя на макроскопични Microstates извършване на тази macrostate. По дефиниция W³ 1. т.е. термодинамична вероятност не е veroyanost P в математическия смисъл на думата (P £ 1).
Например, един мол кислород macrostate съответния физически P = 1 атмосфера и Т = 300 К може да се осъществи брой Microstates W =. Представете си, тази цифра е напълно невъзможно.
Болцман през 1872 г. е показано, че ентропията на системата и термодинамична вероятността свързани със следната формула
където к - е постоянна Болцман. За горния пример S = 200 J / К.