Крайните продукти от разпадането на аминокиселини
В резултат на различни трансформации на аминокиселини в тъканите на тялото са оформени амоняк, въглероден двуокис и вода.
след дезаминиране # 945-амино форма киселина азот без съединение. Вече знаем, че голямата част от него # 945; кето киселини, които са подложени на дехидрогенирането и декарбоксилиране, и в крайна сметка се превърне в Н 2О и СО2.
Някои кето киселина, се подлага на окислително декарбоксилиране да образуват киселини с различни химически структури, в зависимост от това къде в някои случаи те се окисляват по пътя # 946; окисление, а в други - в преобразуването на въглехидрати. Въпреки това, в тези случаи накрая образува СО2 и Н2 О. въглероден диоксид е частично отделя, останалата част се използва за синтетични методи, например, за синтез на висши мастни киселини и други пуринови бази.
Обмен на амоняк. Основният източник на амоняк в тялото от аминокиселини. Амоняк - силно токсично вещество. Дори и леко повишаване на неговото количество в кръвта причини отравяне на организма, особено на нервната система.
Ежедневно при хора деаминиран около 100-120 грама на аминокиселини, което съответства на приблизително 18-23,6 г амоняк. Все пак, въпреки непрекъснато образуването на амоняк в тъканите и притока на кръв, неговата концентрация в кръвта е много малък. Дори в капилярите на бъбреците, където най-голямо количество амоняк, концентрацията не надвишава 1 мг% нормален. По време на еволюцията на един човек да се развива на специален режим на негово разположение. Те включват образуването на глутамин, аспарагин, амиди на протеини, редуктивно аминиране, неутрализиране на киселини, синтез на карбамид.
Един от най-важните механизми на неутрализация на амоняк е образуването на глутамин и аспарагин. Синтез на амиди на тялото е важно, защото потоците в директен образуването на места амоняк: в черния дроб, мозъка, бъбреците, ретината, мускул. Глутаминова и аспартамова киселини в тъкани, които винаги са в свободно състояние, се свързват амоняк чрез реакция на амидиране. В резултат на глутамин глутаминова киселина се образува от аспарагинова - аспарагин. Тези реакции протичат при използване ензими глутамин и аспарагин:
По този начин се неутрализира с амоняк може да се използва от организма, като източник на азот, например, за синтез на пуринови и пиримидинови бази, гликозаминогликани, и т.н.
В човешки тъкани, има и друга ензимна механизъм на неутрализация на амоняк - това свързване чрез амидиране на карбоксилни групи на протеините тъкани. Амидиране протеин, причинени от присъствието в тяхната структура на свободните карбоксилни групи на глутаминова и аспартамова киселини.
Част от амоняк се неутрализира чрез редуктивно аминиране реакции - обратна на деаминиране, което осигурява свързването на амоняк за да образуват съответните кето киселини на аминокиселини. Главната роля в този # 945; -ketoglutarovoy киселина.
Малко количество амоняк, използван за неутрализиране на неорганични и органични киселини, което води до образуване на амониеви соли. Този процес неутрализация на амоняк се среща само в бъбрека. Основният начин на неутрализация на амоняк, свързани с образуването на карбамид.
Синтезът на урея е основен от амоняк детоксикация при бозайници, а основната форма изолация протеин азота от организма. Карбамид, което е неутрално съединение, което е разтворим във вода, се екскретира в урината. Урея сметки за 80-85% от общото количество на азотни вещества урина.
Първо урея схема синтез препоръчва MV Nentsky. Оказа се, че синтезът на това съединение се дължи на два амоняк молекули и една молекула на въглероден диоксид.
В специални експерименти I. V. Залески и SS Salazkin установено, че основното тяло има, когато неутрализация на амоняк и синтез на карбамид, е черният дроб.
образуване на карбамид се осъществява с участието на редица ензими и вещества за даден цикъл, наличието на които е доказано от Б. Krebs и К. Henselaytom, във връзка с който този цикъл се нарича цикъл урея, или цикъла на Кребс - Henselayta. В цикъла на уреята, има два основни етапа: първият е придружено от синтеза на аргинин, втората хидролиза на аргинин към орнитин и образуване на карбамид.
Сега е установено, че източникът на една молекула амино урея е амоняк, образувана по време на оксидативното деаминиране на глутаминова киселина в митохондриите:
Глутаминова киселина + NAD + + H 2 O → # 945; -Ketoglutarovaya киселина + NAD • H + Н + + NH3.
Това амоняк с СО2 образуване съединение karbamoilfosfat. Реакцията протича под действието на ензим karbamoilfosfatsintetazy на използване на енергията на две молекули АТР:
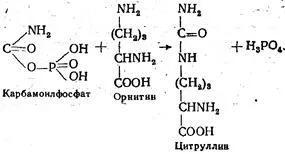
Karbamoilfosfat нататък взаимодейства с орнитин което се образува цитрулин и фосфорна киселина. Реакцията се катализира от ензима ornitintranskarbamilazoy на:
В следващия етап в цикъла на уреята участва втората амино група, която е амино група на аспарагинова киселина с глутаминова образувана от ензим аспартат: глутамат - аминотрансфераза:
Глутаминова киселина + оксалоацетат киселина → # 945; -Ketoglutarovaya киселина + аспартова киселина.
По този начин, източникът на амоняк за синтез на карбамид в крайна сметка е глутаминова киселина, в които всички фонд аминогрупи сглобени Получената реакции между трансанимиране # 945; амино-киселини, образувани по време на хидролитично разцепване на протеини в канала храна и # 945; -ketoglutarovoy киселина. Това още веднъж подчертава важната биологичната роля на глутаминова киселина в азотния метаболизъм.
Следните реакции са придружени от превръщане на цитрулин varginin. Първо, цитрулин взаимодейства с аспарагинова киселина с синтетаза argininosuccinic киселина за образуване argininoyantarnoy киселина. В тази реакция, един използва енергията на АТР молекули:
След argininoyantarnaya киселина се подлага на ензимно разцепване за получаване на фумарова киселина и аргинин:
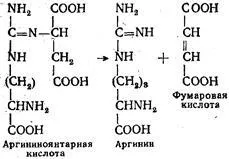
Реакцията се катализира argininosuktsinatliazoy. Това завършва първия етап от синтеза на карбамид.
Фумарова киселина се връща в цикъла на трикарбоксилна киселина, където тя се превръща в оксалоацетат. Последният реагира с глутаминова киселина, аспартамова отново форми, които вече е известно да ни етап на цикъла урея предава своя амино цитрулин.
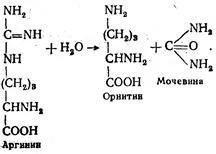
Във втория етап полученият аргинин чрез действието на аргиназата отцепят хидролитично в орнитин и карбамид:
Орнитин може отново да реагира с karbamoilfosfatom и целият цикъл започва отново.
По този начин, при хора и животни, по-високи, има силни механизми достатъчно освобождаване на амоняк и го използва за биосинтеза. Амонякът е не само крайния продукт на протеиновия метаболизъм, но също конструкция материал за образуването на много съединения.
Качество белтъчна храна
Протеини, както знаем, са основната пластмасов материал на тялото, които не могат да бъдат заменени с други вещества.
Най-ценни са протеини, в които достатъчно количество съдържа всички незаменими аминокиселини, изисквани от тялото (т.е., такива, че тялото не е синтезиран или синтезиран в много малко количество).
Така, биологичната стойност на протеина се определя от състав качествен ikolichestvennym аминокиселина включени в молекулата си.
За човек ценни са млечни протеини, месо, пиле и яйца, растителен протеин - картофен протеин, който от своя протеин биологична стойност надхвърля не само хляб, но по отношение на някои аминокиселини, млечен протеин дори краве.
Смесеният диетата на 110-120 грама на протеин, 40-60 грама от мазнина и 600-700 грама въглехидрат трябва да съдържа най-малко 50% от животински протеини. Такава диета предвижда необходимостта на организма за всички незаменими аминокиселини.
Един от основните начини за превръщане на амино киселини, образувани по време разделянето на хранителен протеин в канала храна е да ги използват за видове специфичен протеин биосинтеза. Този процес протича с различна скорост във всички органи и тъкани.
Всеки ден в човешкото тяло произвежда около 1,3 грама протеин на 1 кг телесно тегло. Имайки предвид, че средното човешко тегло 70 кг, синтезираните на ден за 90 грама протеин в тялото му. Общото количество на протеин в тялото е 12-14 кг. По този начин, те се актуализират в около 135-155 дни.
Синтезът на някои протеини в тялото настъпва много бързо. Например, в продължение на 1 и в кръвта се унищожават и на новосинтезирани около 3 Mill. Еритроцити, всяка съдържаща приблизително 300 молекули на хемоглобина. Като цяло, синтезът на протеинови молекули в жива клетка завършва с 2-3.
Рибозомата има две места - аминоацил или А-мястото и пептидил или U-сечение. Аминоацил част служи за закрепване на аминокиселини, произхождащи от цитоплазмата, които са необходими за синтеза на протеини и образуване на пептидна връзка между тях, пептидил - за провеждане на нарастващата полипептидна верига (Фигура 44).
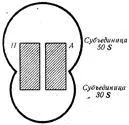
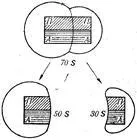
Най-проучен са рибозомите на бактериалните клетки. Всички клетки бактериалната рибозома 70S се посочени като образуване дисоциира в две субединици - 50S и 30S (Фигура 45) (S - утаяване постоянни отделни субединици и рибозоми като цяло). Субединичните 50S и 30S имат различен набор от протеини. Известно е, че някои от тях да действа като катализатор.
В клетката на рибозомите то обикновено е под формата на групи от 3 до 100 единици, формиращи polyribosomes или политики. Полизомите индивидуални рибозомите са свързани помежду си с един вид нишка, която е видима под електронен микроскоп. Тази нишка е РНК (фиг. 46). Всяка рибозом е в състояние да синтезира единична полипептидна верига, рибозом група, т.е. полизоми, - няколко от тези схеми.
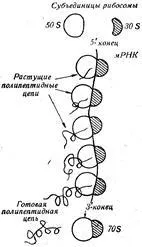
биосинтеза път на матричен протеин. Както е известно, разликата между един индивид от друг протеин се определя главно от естеството и последователността на аминокиселината на редуване, в състава, т.е. първична структура. Прехвърлянето на такава информация и е една от основните характеристики на протеин биосинтеза.
Център за контрол на синтеза на протеини е клетъчното ядро, което съдържа цялата информация носител - ДНК молекула. Информацията кодирана в ДНК на специфична последователност на азотни основи в молекулата си. Трансфер наследствени характеристики, информация за първичната структура на протеина чрез информационна РНК (иРНК), който се синтезира в специфичната област (ген) на една от нишките на ДНК. В основата на принципа на предаване на информацията допълване (вж. Гл. 15).
Припомнете си, че синтеза на иРНК е, че ДНК молекула, имаща формата на двойна спирала се развива в определени моменти в определени области (тази част се нарича ген). На всеки сук част е изработена от двете ДНК вериги на молекулата на иРНК на базата на допълване. Възниква вид "измама" припокриване цел на азотни основи сук порция на един от ДНК вериги на молекулата на РНК. Този процес на "измама" на информация се нарича транскрипция.
В резултат на транскрипция от порядъка на азотни основи редува тРНК молекула допълнителни повторения на последователността на азотни основи на ДНК молекула сук част. Така тРНК молекула получава информация за първичната структура на протеина.
След в цитоплазмата, молекулата на иРНК е "обрасли" с рибозоми и служи като шаблон, на която е конструирана протеин в съответствие с приложената информацията за реда на аминокиселини. Процесът на прехвърляне на информация от тРНК, която се състои в строго определена последователност от нуклеотиди в своите промеждутъчни молекула език амино киселина протеинови молекули е известно като превод.
Поради факта, че за синтеза на протеин със специфичен първична структура използва информацията, съдържаща се в молекулата на иРНК, която служи като матрица, този път се нарича матричен протеин синтез. самата ДНК директно включени в биосинтеза на протеин не приема, че само осигурява тРНК с цялата необходима информация.
Накратко матричен протеин биосинтеза път може да бъде представена както следва;
ДНК РНК протеин.
Процесите, свързани с ДНК репликация, транскрипция и транслация, започва с началото на тялото и с различна интензивност появят през целия живот.