концентрации Преизчисление разтвор
Пример 1: Колко мл разтвор на сярна киселина с масова фракция 0,96 плътност 1,84 грама / мл се изисква за получаване на 500 мл 0.5N. разтвор.
Решение. Моларен маса на сярна киселина
Моларен еквивалент тегло: Mack (H 2SO 4) = 98 • 1/2 = 49 грама / мол.
Намираме теглото на сярна киселина, съдържаща се в 500 мл 0.5N. решение:
Намираме тегло 96% разтвор на сярна киселина, съдържаща m (H 2SO 4) = 12,25 г
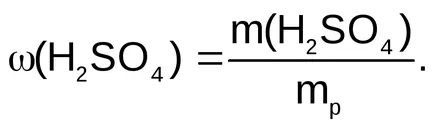
Намираме обем на 96% -ен разтвор на сярна киселина с тегло 12.76 грама
По този начин, за получаване на 500 мл 0.5N. разтвор на сярна киселина изисква 6,9 мл разтвор на сярна киселина с масова фракция 0.96.
ПРИМЕР 2 Плътност на 0.5М разтвор на натриев карбонат беше 1.05 гр / мл. Изчислява се масовият процент на Na2 CO3. титър разтвор, еквивалентен моларна концентрация и молалност разтвор.
Решение. Приемане на 1 л разтвор. Моларната концентрация на 0.5М Na2 CO3 разтвор. Следователно, в един литър разтвор, съдържаща 0,5 мол Na2 CO3. Ще намерите цялата необходима информация за изчисляване на концентрациите.
Тегло на разтвор: т.т. = Vp • ; т.т. = 1,000 • 1,05 = 1050
Моларен маса: M (Na2 CO3) = 106 грама / мол.
Фактор еквивалентност FEK (Na2 CO3) = 1/2.
Молар еквивалентно тегло:
Количеството вещество: N (Na2 CO3) = 0,5 мол.
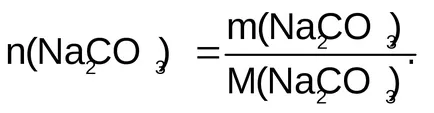
Еквивалентно количество вещество:
m (Н 2О) = 1050 - 53 = 997 G = 0.997 кг.
Намери фракцията на масата на разтвореното вещество Na2 CO3.
Това означава, че в 100 г разтвор съдържа 5 г Na2 CO3. Тигърът се намери решение:
Това означава, че в 1 мл разтвор съдържа 0,053 гр на Na2 CO3.
Виж моларните концентрации еквивалентни:
Това означава, че в 1 литър от разтвора, съдържаща 1 мол Na2 CO3.
Намираме molal концентрацията
Това означава, че 0,502 мол Na2 CO3 съдържа в 1кг Н2О
5.2. електролитна дисоциация
Разпадане електролитни молекули на йони под въздействието на молекулите на полярен разтворител, наречени elektroliticheskoydissotsiatsiey. Вещества водни разтвори или стопилки, които провеждат електричество са посочени като електролити.
Те включват вода, киселини, основи и соли. Когато се разтваря във вода, електролити молекули се разпадат в положителни йони - катиони и отрицателни - аниони. Процесът на електролитна дисоциация поради взаимодействието на вещества с вода или друг разтворител, в резултат на образуването на хидратни йони.
Така водороден йон форма хидрониев йон:
За да се опрости хидрониев йон се записва без водни молекули, т.е. Н +.
или приета влизане: NaCl Na + + Cl -.
Дисоциацията на киселини, основи, соли
Киселини наречен електролити, които се разпадат, за да образуват катиони като катиони само водород. Например,
Полиосновна киселина стъпки дисоциация. Например сероводородна киселина дисоциира стъпки:
Н2 S Н + + HS - (първи етап)
HS - Н + + S 2- (втори етап)
Дисоциация многооснов киселини протича главно от първия етап. Това е така, защото енергията, която трябва да бъде изразходвано за отделяне на йони от неутрални молекули. е минимален и става по-голяма, когато разпадането на всеки следващ етап.
Основи наречени електролити, които се разпадат в разтвор за образуване на анион като само хидроксид йони. Например,
Mnogokislotnye база се разпадат поетапно
Mg (OH) 2 MgOH + + OH - (първи етап)
MgOH + Mg2 + + OH - (втори етап)
Стъпаловидно киселина и основа дисоциация обяснява образуването на кисели и основни соли.
Има електролити, които се разпадат в същото време като основен и като киселина. Те се наричат амфотерни.
Н + + RO - ROH R + + OH -
Амфотерно обяснено сила малка разлика връзка R-H и О-Н.
Чрез амфотерни електролити включват вода, хидроксиди на цинк, алуминий, хром (III), калай (II, IV), олово (II, IV), и други.
Дисоциацията амфотерен хидроксид като Sn (ОН) 2. може да се изрази с уравнението: