Класическия модел на атома Rutherford
Модел на атома. 1903 от J .. J. Thomson, предложен модел на атома, съгласно който атом е сфера равномерно изпълнен с положителен ток. Електроните са потопени в тази среда и да си взаимодействат с елементи на околната среда в съответствие със закона на Кулон (фиг. 4.1, а). Според този модел обикновено неутрален атом: общият заряд на сфера и заряда на електрон е нула. Спектърът на атом е трябвало да бъде трудно, но в никакъв случай не означава линия спектър, която е в противоречие с експерименталните данни. Според Thomson модел вибриращо електрон (осцилатор) да могат да излъчват електромагнитни вълни. В случай на електрон от равновесното си положение, сили, които се опитват да го върнат към равновесното си положение. Това създава трептения на електрона, които предизвикват емисии на атом.
Беше предложено като модел на атома, показано на фиг. 4.1b. атом се състои от сфера, в центъра на който е положително заредена ядро и електрони са разположени около него. Въпреки това, този модел не може да обясни резултатите от експерименти.
Най-известният планетарен модел на атома, предложен от английски физика Е. Rutherford (фиг. 4.1, в).
Ранните опити за изучаване на строежа на атома е направена
Е. Ръдърфорд и неговите сътрудници E.Marsdenom и H.Geygerom в 1909-1911 години. Rutherford, предложен атом сонда да се прилагат чрез # 945; частици, които възникват по време на радиоактивното разпадане на радий и някои
други елементи. бяха направени възможни Тези експерименти с откриването на радиоактивност в който в резултат на естествена радиоактивния разпад на тежки елементи разпределени-частици, които имат положителен заряд равна на заряд на два електрона -particle масови 4 пъти по-голяма от масата на водороден атом, т.е. те са йони на хелий атом. Енергията на частици, изпускани от различни тежки химични елементи, варира от уран ЕГ на ЕГ за торий. тегло # 945; частици около 7300 пъти електрон маса, и положителен заряд, равен на два пъти по-елементарен заряд. В тези експерименти използвахме # 945; -частици с кинетична енергия, от 5 MeV. съответстваща на тяхната скорост от около м / сек.
Тези частици са бомбардирани фолио на тежки метали (злато, сребро, мед и т.н.). Електроните са включени в атомите не се променят траекторията дължи на ниската маса # 945; -частици. Разсейване, т.е. промяната в посоката на движение # 945; частици може да предизвика само тежки положително заредени част на атома.
Целта на експеримента Rutherford беше да се тества експериментално основно положение на модела атом, предложен от Thompson.
Шофиране опит на Ръдърфорд разсейване # 945; частици е показано на фиг. 4.2.
Тук К - олово контейнер с радиоактивно вещество, д - екрана е покрита с цинков сулфид, F - златно фолио, М - микроскоп. От радиоактивен източник, затворник в контейнера за олово, # 945; -частици бяха насочени към тънък метално фолио. Дебелината на фолиото е т (1 микрон), еквивалентни на около 400 слоя златни атома. разсеяна фолио # 945; -частици върху екрана покрити със слой от цинков сулфид кристали способен блясък при удари на енергетичните заредени частици. Сцинтилационен (флаш) на екрана се вижда окото на

наблюдения, разпръснати # 945; частици в експеримент Ръдърфорд могат да се извършват под различни ъгли # 966; към оригиналната посока на лъча. Установено е, че по-голямата част от # 945; частици преминават през тънък слой от метал, практически тестване отклонение. Въпреки това, една малка част от частиците все още се отклонява през големи ъгли в излишък от 30 °. много редки # 945; -частици (около десет хиляди) бяха тествани за огъване ъгли близо до 180 °. Този резултат е неочакван, тъй като Това е в противоречие с модел слива пудинг, съгласно която положителния заряд се разпространява в целия обем на атома. С такова разпределение на положителен заряд не може да създаде силно електрическо поле, способен да капка # 945; -частици преди. Напрегнатостта на електрическото поле е равномерно заредена с максималната си повърхност купа и намалява до нула, тъй като се доближава до центъра на топката. Ако радиусът на областта, който се концентрира всички положителния заряд на атома, намален п пъти, максималната отблъскваща сила действа на # 945; -particle от закона на Кулон, щеше да се увеличи с N 2 пъти. Тогава за достатъчно големи стойности на п # 945; -частици могат да бъдат разпръснати чрез големи ъгли до 180 °. Тези съображения са довели до заключението, че Ръдърфорд атома е почти празен, а цялата си положителен заряд е съсредоточен в малък обем, който има размери от порядъка
10 -14 m. Тази част се нарича Rutherford atomnymyadrom атом. Електроните съгласно Rutherford, движещи се около ядрото с размер от порядъка на 10 -14 m. Така че ядрената атомен модел (фиг. 4.1).
Въз основа на получените резултати, Rutherford, тъй атома, електрони може да не засягат значително разсейване на бързо и относително тежки частици, той е съставен заключения, които са на базата на планетни (ядрени) модели на атома:
1) съществува ядро, при което цялата маса се концентрира атом и всичките му положителен заряд, при което размерът на ядрото е много по-малък от размера на атома;
2) електрони, които са част от ядрата на атомите се движи в кръгови орбити.
Като се започне от тези две допускания и предположението, че взаимодействието между -particle падащата и положително заредена ядрото се определят от Кулон сили, Rutherford установено, че атомните ядра имат размери т. Т.е. те са просто по-малко от атомни размери. Ядрото заема само от 10 до 12 от общия обем на атома, но съдържа всички положителен заряд и най-малко 99,95% от неговата маса. Веществото съставляващи ядрото на атом има огромен плътност # 961; ≈10 17кг / м 3. заряд на ядрото трябва да бъде равен на общия заряд на електроните, принадлежащи към атом. Впоследствие е установено, че ако таксата за електрон се приема като единство, тогава ядрен заряд е точно равен на броя на елементите в периодичната таблица. Големината на положителен електрически заряд Z атомното ядро определя от броя на протоните в ядрото (и по този начин броя на електроните в атомните черупки), която съвпада с поредния номер на елемент от периодичната таблица. Обвинението е Ze. където е = 1.602 х 10 -19 Cl - абсолютна стойност на елементарен електрически заряд. Charge определя химичните свойства на всички изотопи на даден елемент.
През 1911 г. Ръдърфорд, използвайки закона на Кулон, получава формула
където N - брой # 945; частици, които попадат за единица време на обектива; DN - размера на разпръснати за единица време # 945; частици в твърда ъгъл г # 937; ъгъл # 952; ; Зе и п - заряд дифузери ядра и тяхната концентрация; DX - дебелината на слоя фолио; V и т # 945; скоростта и масата на # 945; частици.
Директни експерименти за измерване на заряда на ядрата на базата на формулата Ръдърфорд Чадуик са извършени през 1920 година. Експерименталната настройка е показана на Фиг Chadwick. 4.3.
А пръстен дифузьор (защрихованата на фиг. 4.3), разположени коаксиално и на равни разстояния между източника и детектора и # 945; частици D. При измерване на количеството разсеяна DN # 945; частици порт затваря екран в пръстена, който абсорбира директна светлина # 945, частици от източника
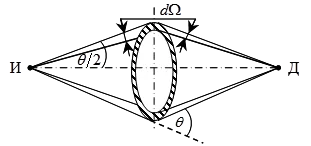
детектора. Детектор регистрирани само # 945; -частици, разпръснати в твърда
ъгъл г # 937; ъгъл # 952; до падналия лъч # 945; частици. Тогава пръстен припокрива екран с дупка и се измерва плътността на тока # 945; частици на мястото на детектор. От получените данни, броят на изчисленото N # 945; частици удрящи на пръстена в даден момент. По този начин, ако знаем енергията # 945; - частиците, отделяни от източника, лесно определена стойност Z във формула (4.1).
формула Rutherford е използван да обясни експерименталните резултати на разсейване # 945; частици с тежки ядра. което доведе до откриването на атомното ядро и създаването на ядрения модел на атома.
атомен модел, предложен от Rutherford напомня на слънчевата система. Ето защо моделът се нарича Ръдърфорд планетарен модел на атома. Този модел е важна стъпка към модерното понятие за структурата на атома. Нейната основна концепция на атомното ядро, което се концентрира всички положителния заряд на атома и почти всички от неговата маса, е запазил своята стойност до момента.
Въпреки това, за разлика от планетарен модел на слънчевата система, планетарния модел на атома е самостоятелно противоречиви от гледна точка на класическата физика на. Това се дължи главно на наличието на заряда на електрона. Според законите на класическата електродинамика, електрон върти около ядрото, като всеки бързодвижещи се заредена частица излъчва електромагнитни вълни. Спектърът на такава радиация трябва да бъде непрекъснато, т.е. включва електромагнитни вълни с всяка дължина на вълната. Още този извод е в противоречие с Емисионните спектри линия на атома наблюдавана експериментално.
В допълнение, непрекъснатото излъчване намалява кинетичната енергия на електрона. Ето защо, поради Изисква излъчването на движещ радиус на орбитата на електрони да бъде намалена, и, в крайна сметка, на електрона трябва да падне в ядрото, според оценки, с течение на времето. Въпреки това, в действителност водороден атом е стабилен и "дълъг живот" електромеханична система. С други думи, на планетарния модел на атома от гледна точка на класическата физика е нестабилна.