Йонни кристали - studopediya
Такива вещества са образувани чрез химична връзка, която се основава на електростатични взаимодействия между йоните. Йонна връзка (от тип полярност - heteropolar) е ограничена главно за двукомпонентни системи тип NaCl (ris.1.10 а), който е монтиран между атомите на елементите, които имат най-висок афинитет за електрони, от една страна, и атоми на елементи, които имат най-ниската потенциал йонизация, от друга страна. При образуването на йонна кристал, най-близките съседни на йони са йоните на обратен знак. В най-благоприятното съотношение на размера на положителни и отрицателни йони, те докосват един друг, и постига изключително висока плътност опаковка. Малка промяна в по-йонна разстоянието в посока на намаляване си от равновесие поражда отблъскващи сили на електронен слой.
Степента на йонизация на атомите, които образуват йонни кристал, често такова, че електрони обвивка на йоните съответства на електронен слой характерни за инертни газове атома. Приблизителна оценка на енергията на свързване може да се направи, като се предполага, че по-голямата част от него се дължи на Кулон (т.е., електростатично) взаимодействия. Например, в кристална NaCl разстояние между съседни положителни и отрицателни йони е около 0.28 пМ, която дава стойността на потенциалната енергия, свързана с взаимното привличане на двойка йони, около 5.1 ЕГ. Експериментално определеното енергийната стойност на 7.9 ЕГ NaCl за молекула. По този начин, както на същия порядък и позволява използването на този подход за по-точни изчисления.
Йонни връзки са ненасочени и ненаситени. Последният ефект е, че всеки йон се ангажира да доведе до него най-голямо количество йони на обратен знак, че е за образуване на структура с висока координация номер. Йонна връзка общ сред неорганични съединения: метални халогениди с сулфиди, метални оксиди и т.н. свързващата енергия в тези кристали е няколко електронволта на атом, така че тези кристали имат голяма сила и висока точка на топене ..
Ние изчисляваме енергията на йонна връзка. За да направите това, ние си спомняме компоненти на потенциалната енергия на йонно кристална:
Кулон привличане на йони на обратен знак;
Кулон отблъскване на йони е от същия знак;
квантово-механично взаимодействие с припокриващи електронни черупки;
ван дер Ваалс привличане между йоните.
С основен принос за енергията на свързване на йонни кристали прави електростатично енергията на привличане и отблъскване, ролята на последните две депозитите е незначителен. Ето защо, ако ние означаваме енергията на взаимодействие между йоните и I чрез й. общата енергия на йон с всичките му взаимодействия ще бъде
Ние даваме като сбор от отвратителните и атрактивни потенциала:
когато знакът "плюс" се приема като едно и също, и "минус" - в случая с противоположни заряди. Общата енергия на йонната кристалната решетка, която се състои от N молекули (2N йони) ще
само веднъж трябва да се разглежда при изчисляването на общата енергия на всеки сътрудничещ двойка йони. За удобство, ще се въведе следния параметър. където - разстоянието между две съседни (противоположно заредени йони) в кристала. по този начин
където константната Madelung [4] # 945; постоянна и D са дефинирани както следва:
Суми (2.44) и (2.45), следва да се вземат предвид приноса на цялата решетка. "Plus" знак съответства на привличане на противоположни йони, знакът "минус" - отблъскването като йони.
Константата се определя по следния начин. В равновесие, общата енергия е минимално. Следователно ,. и затова трябва
където - равновесната разстоянието между съседни йони.
и изразът за общата енергия на кристала в състояние на равновесие става
стойност

Като пример се изчисли константа за едномерен кристал Madelung - една безкрайна верига на обратен знак йони, които се редуват (Fig.2.4).
Fig.2.4. двумерен кристал
При избиране йон, например, марка "-", както и първоначалните, ще има две йонна знак "+" в К0 на разстояние от нея, две йонна марка "-" в региона 2r0, и така нататък.
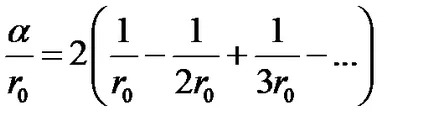
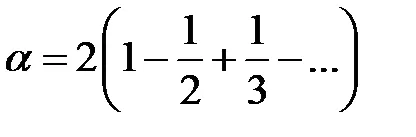
Използване на разширение серия
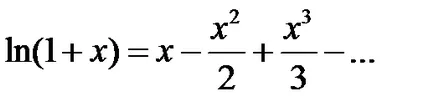
Така, експресията на енергията на една молекула е под формата
В случай на триизмерен кристал серия клони условно, т.е. резултат зависи от метода на прибавяне. Възможно е да се подобри сближаването на поредицата, ако се изолира йони в решетката на групата, така че групата е електрически неутрален, и ако е необходимо, да се разделят на йон между различните групи и се прилагат частични такси (метод Evjen).
Считаме таксите по лицата на кубичната кристална решетка (фигура 2.5), както следва: такси за лицата принадлежат към два съседни клетки (всяка клетка е 1/2 от заряд), таксите по ръбовете на клетките принадлежат към четири (1/4 във всяка клетка), такси на върховете принадлежат на осем клетки (1/8 във всяка клетка). принос към # 945; от първия куб може да се запише като сбор от:
Ако вземете следващата по големина куба, който включва разглеждане на нас, ние получаваме. който е съгласен и с точната стойност за съответния тип решетка. За структури от типа получен. тип структура -.
Фигура 2.5. Решетка модел с дробни такси за изчисляване на сумата от метод Madelung Evjen
Нека да изчислите енергията на свързване на кристала. се предполага, че параметърът решетка, и модул на еластичност по известен. Модулът на еластичност може да се определи, както следва:
където - обемът на кристала. Обемният модула е мярка за компресия под хидростатично налягане. За кубичен (FCC) обем тип структура лице центриран която е заета от молекулите е домакин
Тогава можем да запишем
От (2.53) може лесно да се получи второ производно
Първият производно на състоянието на равновесие е нула, следователно от (2.52-2.54) определя
Ние използваме (2.43) за да се получи
От (2.47), (2.56) и (2.55) намираме по-голямата част модул B:
Уравнение (2.57), дава възможност да се изчисли експонентата в отблъскващ потенциал, както и използването на експерименталните стойности. За кристал. , , Тогава от (2.57) имаме
Имайте предвид, че за най-йонни кристали експонента п в потенциални отблъскване сили варира между 6-10.
Следователно, голяма стойност на степента на къси разстояния причинява отблъскваща сила. Използването на (2.48), ние се изчисли енергията на свързване (енергия на молекула)
Това е съгласен и с експерименталната стойност на -7.948 ЕГ / молекула. Трябва да се помни, че изчисленията, които взехме под внимание само Кулон сили.
Кристали с ковалентна и йонни видове комуникация могат да се разглеждат като ограничаващи случаи; е число между кристали, които са междинни типове връзки. Такова частично йонна () и частично ковалентна () връзка може да бъде описан от функцията на вълната
в този случай, ionicity се определя, както следва:
В Таблица 2.1 показва някои примери на кристали на двоични съединения.
Таблица 2.1. Ionicity кристали