Изчисляване на промяната в енергията на химическа реакция при стандартна температура Gibbs
Изчисляването на енергийните промени Гибс на химическа реакция при стандартна температура (298 К) може да се осъществи със съответните референтни данни за варианти на стандартни потенциали на образуването на вещества
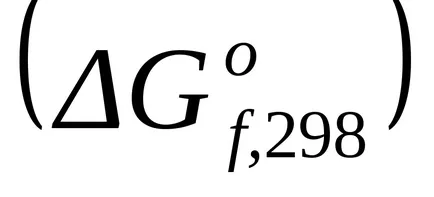
стандарт Gibbs енергия промяната в образуването на прости вещества стабилни нула.
Друг метод за изчисляване на стандартното отклонение на Гибс енергията на химическата реакция е използването на уравнението на Гибс-Хелмхолц:
където Т = 298 К;
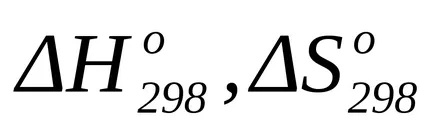
Изчисляване на промяната на Гибс енергията на химическа реакция в нестандартно температура,
Изчисляването на Свободна енергия на Гибс промени в химична реакция при температура обикновено произвеждат неправилна над уравнението на Гибс-Хелмхолц:
където Т - температура на реакцията;
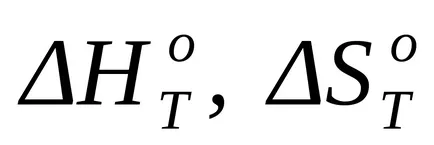
Когато приблизителни изчисления могат да използват предположението, че промените в енталпия и ентропия са независими от температурата, както и изчисленията се прилагат стойностите им по подразбиране, както и резултати за температурата на 298К:
където Т - температура на реакцията, за което се извършва приблизително изчисляване.
При липса на фазови преходи за точно изчисляване на стандартната енергия промяната Gibbs при температура Т (
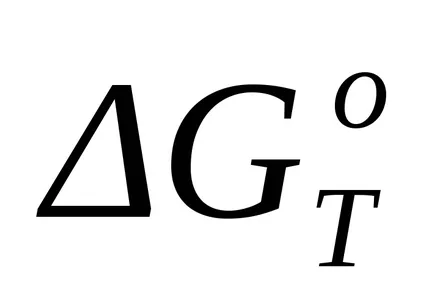
където Т - температура, при която се появява на реакцията; Аа, АЬ, Ас, Ас - коефициентите на съответните сили на Т получени чрез изчисляване ΔSP; Mo, М1, М2, М2 - коефициентите на Аа, АЬ, Ас, Ас съответно до предварително определени температури са дадени в наръчници за определен метод за изчисление.
ПРИМЕР Пример 1.15. Изчислява приблизителната и точно промяната на Гибс енергия на химическата реакция при Т = 298 К и Т = 1800 К и за определяне на възможността за възникването му при дадените температури:
Необходимите справочни данни са представени в таблица. 1.10.
Е стандартен термичен ефект като енталпия промяната от известните топлини на образуване на формула (1.17):
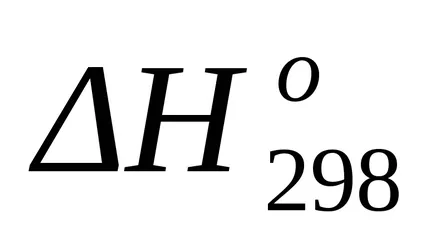
стандарт Промяната на ентропията от формула (1.38):
стандарт Гибс енергия Промяната на най-Т = 298 К на находка
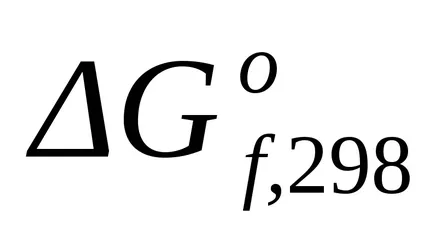
стандарт промяната на енергия Gibbs при Т = 298 К и бяха изчислени съгласно уравнение (1.43):
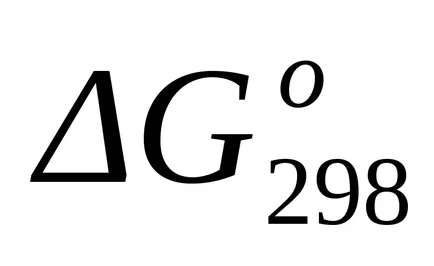
стандарт Gibbs енергия промяната на при Т = 1800 К намерите приблизителна формула (1.46):

Тъй като при температури от 298 К и 1800 K
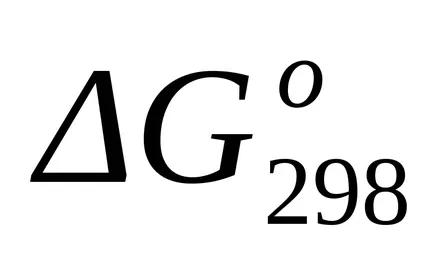
Точният начин на изчисляване на
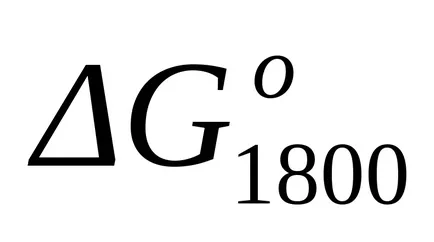
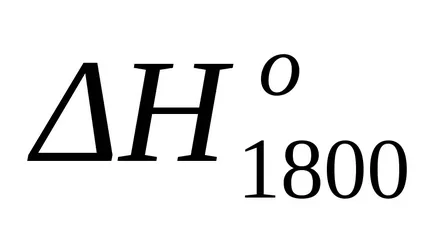
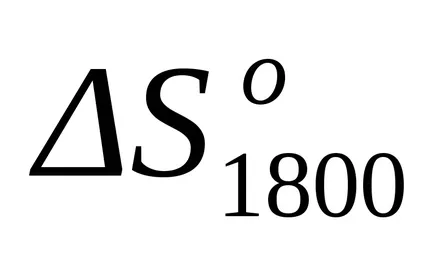
Аа = (25,02 + 2 х 30.00) - (62,86 + 2 х 27.28) = - 32.40;
Уравнение промени топлинна мощност в зависимост от температурата след смяна на намерените стойности Аа, АЬ, Ас ще имат форма:
След замяна на това уравнение във формула (1.25) и (1.39) изчислява енталпия промени и промени ентропията за реакцията при Т = 1800:

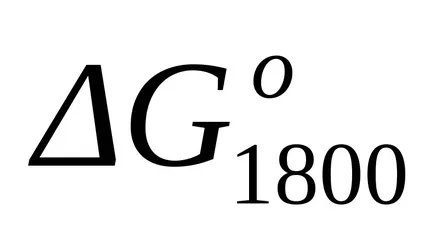
Тъй като стойността на резултатите от Гибс промени енергия
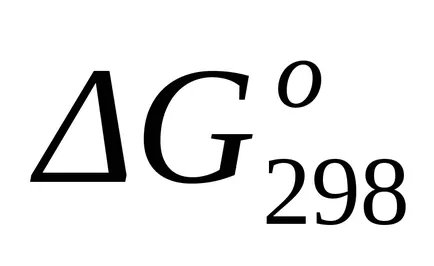
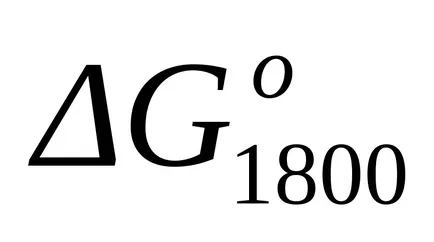
ПРИМЕР Пример 1.16. Изчислява се промяната в Gibbs свободна енергия на химическата реакция от пример 1.15 при Т = 1800 K чрез метода на Temkin-Шварцман.
Изчислението се извършва съгласно формула (1.47) с позоваване на тази реакция, при което всички участници са неорганични вещества:
Mn стойности са взети от референтни коефициенти до предварително определена температура 1800 К:
стойност
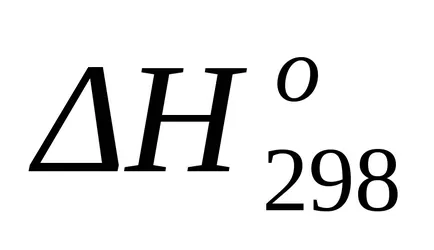
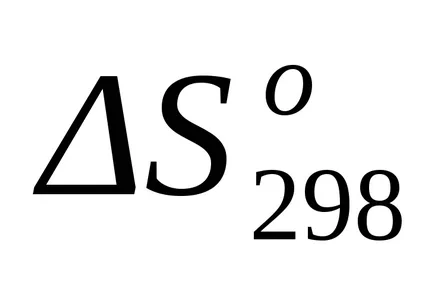
Ние считаме, промяната в Гибс енергията на реакцията при Т = 1800 K: