Имоти алкални Matelli, дистанционни уроци
- Защо са тези метали се наричат "алкални"?
- Когато се разтваря във вода, те образуват алкални.
- И какъв е алкална?
Освен ако не сте в лабораторията и не се свържете директно с различни вещества, такива понятия са много абстрактни ... аз се реализира концепцията за "луга", когато на 1 година в лабораторията изтри "сапун" ръце на синтетичен хавлия и 2 минути намерени в тези места дупки! 🙂
Алкално - сапунена на пипане, а разяждащи вещества. Те са много хигроскопичен (дръпне влагата). За ефектите върху кожата, те са подобни на киселината - просто изяжда и schipyat (ако концентриран).
Но да се върнем към метали.
За да започнете, помислете
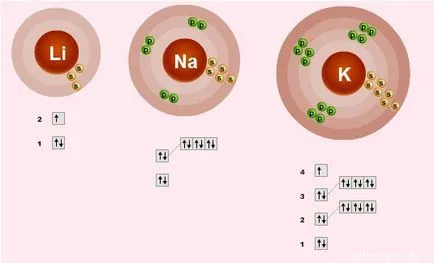
структурата на електронен слой
Електронната структура на външния слой на всички тези елементи са еднакво - това само един несдвоен електрон на S-подниво:

Какво означава това?
- = Valence елементи 1. т.е. всеки атом могат да образуват една връзка.
- Степента на окисление на елементите 1 = + - метални свойства - способността да дари електрони
- От горе до долу в подгрупа атомен радиус увеличава, следователно, по-слабата един електрон се привлича към ядрото на атома, следователно, надолу метални свойства увеличават - Fr силен метал от Li.
- В резултат на това от горе на долу в подгрупа от подобрени възстановителни свойства.
Физични свойства на алкални метали
- всички сребро-бял цвят (CS - жълт)
- мек като пластелин,
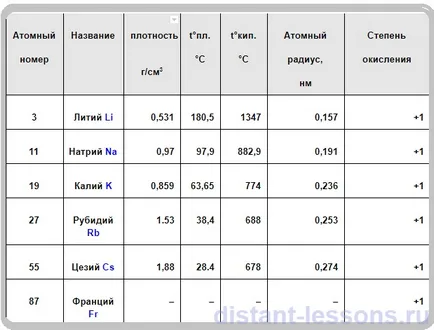

Li - в червено
K - в лилаво
Rb - в червено-кафяв
Cs - червено и лилаво
- Електрическа и топлинна проводимост
Химичните свойства на алкални метали
Логично е да се помисли за химичните свойства на маса класификация на неорганични съединения.
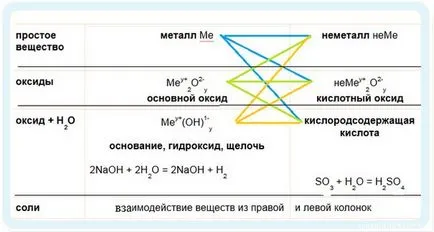
1. Отиваме на стрелките в синьо
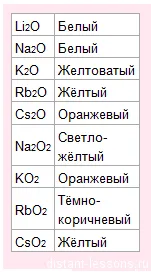
С кислород образува оксиди, пероксиди и супероксиди с различни цветове:
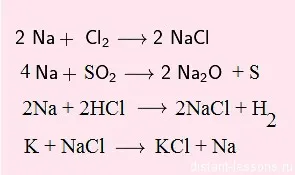
В реакции с kislotami- okislitelyamivodorod не разпределят:

Обърнете внимание на последната реакция - реакция на метална сол:
Не всеки метал може да започне такава реакция!
разтворимост Таблица (е Centerfold във всеки учебник по химия) в долната част има ред:
Тази серия от електрохимична активност на метали. Ние няма да разследва подробно същността на поредицата, и просто да го вземе правило:
в този ред всяка предходна елемент може след това изместване на сол
2. Продължавай зелена стрелка - оксиди за реакция
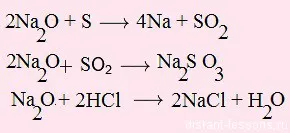
3. Продължаваме оранжевата стрелка, за да
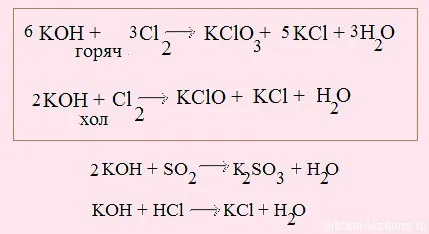
Обърнете внимание на първите две реакции - те се разпределят в рамката. В първата реакция използва горещ алкален - окисляване отива +5 градуса хлор окисление. При използване на студен алкален хлоро окислен само един.
Реакция с алкален киселинни наречени неутрализиране на реакцията. Две силни корозивни вещества неутрализират взаимно, за да образуват вода.
3. Отделно от това, е необходимо да се избере взаимодействие на алкален метал с водород.
Както казахме, от горе на долу в подгрупа от метални свойства на елементи се увеличава. Водородът макар и се съхранява в първата група чрез взаимодействие с алкални метали ще проявяват негативно състояние на окисляване. Получава се с хидриди:
Всички метални съединения на алкални са лесно разтворими във вода.
Това означава, че единственият начин да се определи качеството - това е цвета на пламъка и цветни оксиди. Не утаяване на съединенията не образуват.
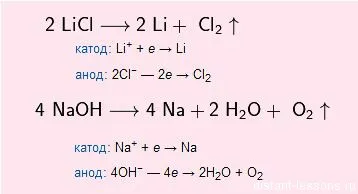
Обикновено алкалните метали чрез електролиза на стопилки или техни алкални соли:
NaCl (електролиза) → Na + Cl2