Хиралност (химия)
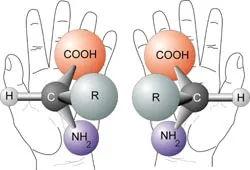
Аминокиселините са примери за хирални молекули
Хиралността (древногръцкия χειρ -. Ръка) - собственост на молекула, не да се комбинират в едно пространство със своя огледален образ [1]. Терминът се основава на древната гръцка титлата най-разпознаваем хирални обект - ръце. По този начин, на ляво и дясно ръцете са огледални образи, но не могат да се комбинират помежду си в пространството. По същия начин, хиралните молекули имат собственост в които не огледало-Sn ротационна ос на симетрия. което е еквивалентно на присъствието на елементи молекула хирални (централната ос и равнина на хиралност и др.). Такава огледално симетрична форма на химичните съединения, наречени енантиомери.
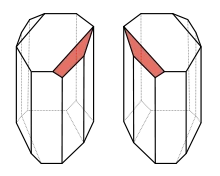
Enantiomorphous кристали дясновъртящ и лявовъртящ тартарат
молекулно конфигурационен ред е бил открит от Луи Пастьор през 1848. Пастьор обръща внимание на факта, че кристали се утаяват от разтвор рацемичен натриев тартарат -ammoniya. Те имат две форми, които са огледални образи, които не съвпадат един с друг в пространството. За разлика от отделните дясновъртящи кристали от натриев амониев тартарат имат същата форма с малки самолети в същата посока. Пастьор прекарва подобен кристализация с тринадесет енантиомерно чисти съединения (различни тартарати и винена киселина) и шестте рацемични тартарати и заключи, че наличието на хирални молекули и обясни неизвестен досега вид изомеризъм винена киселини - енантиомер на [2].
Структурната тълкуването на хиралност стана възможно след въвеждането на 1874 godu J. Van't Hoff и J. Le Belem концепция асиметричен въглероден атом, т.е. четиристенен въглероден атом с четири различни заместители. [2]
Концепцията на конфигурационен ред беше въведен от лорд Келвин в края на XIX век. [3] [4]
Аз наричам всякаква геометрична фигура или група от точки, хирални и да кажа, че тя има конфигурационен ред, ако имиджа си в идеална плоско огледало не може да се комбинира с него.
Оригиналният текст (на английски).
Аз наричам всякаква геометрична фигура, или група от точки, течна, и да кажа, че има хиралност ако имиджът му е плоско огледало, в идеалния случай осъзнах, не може да бъде предявен, за да съвпадне със себе си.
- Уилям Т. Келвин. Балтимор лекции по молекулярна динамика и вълна теория на светлината, през 1904 г.
По-късно V. Meyer удължен концепцията на хиралност в съединенията с азот. и G. W. папа -. серни атоми. селен и калай. Хиралност метални комплекси е изследвана от Werner [5].
Симетрия хирални молекули
Тъй хиралността е геометрична характеристика, може да се определи чрез позоваване на същата молекула или различни симетрия група. Очевидно е, че не е хирални молекули с инверсия център (I) или на равнината на симетрия (и), тъй като тези молекули се състоят от две идентични части, които, когато се отразяват един в друг, и отражението е еквивалентно на родителската молекула. Предишна геометричен критерий на хиралност формулирани както следва: "в хирална молекула не трябва да е равнина на симетрия и център на инверсия." В момента се използва по-точен критерий, което предполага липсата на хирална молекула също са огледално завъртане оси Sn [1] [6].
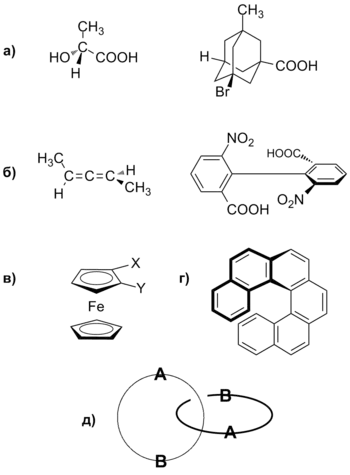
Примери на молекули с (а) централна хиралност; (В) аксиална хиралност; (С) планарна хиралност; (G) спирална хиралност; (D) топологична хиралност
В зависимост от молекулното елемент, чието присъствие води до хиралност, хиралност от следните видове:
- центъра (център на хиралност)
- аксиална (хиралност ос)
- Планарни (хирален равнина)
- спирална (спирала)
- Топология. [6] [7]
Централна хирални
Централна хиралност произтича от наличието на молекула хиралност център (хирален център), която обикновено е асиметричен въглероден атом. 4 с различен заместител. Хиралните центрове могат да бъдат Si атоми. P. S. малко - N [8]. Хиралния център на хиралност адамантан производно е в средата на въглеродния скелет, където атомите не [6].
аксиален (аксиална) чрез конфигурацията на
Аксиалното хиралност възниква в резултат на подреждане непланарни на заместителите около ос - оста на хиралност [9]. хиралност ос съществува в асиметрично заместени Allenes. SP въглероден атом -Hybrid Allen, има две взаимно перпендикулярни р орбити. Тяхната припокриване с р орбитите при съседни въглеродни атоми води до факта, че заместителите в Allenet лежат в взаимно перпендикулярни равнини. Подобна ситуация се наблюдава и в заместени бифенили. при което въртенето около връзката свързваща ароматния пръстен. трудно, както и спироциклични съединения.
равнинни хирални
Равнината на хиралност присъства в производно фероцен. заместени paracyclophanes и др. Използване на местоположението терминът-на равнина описват хирални елементи по отношение на хиралността на молекула равнина [10].
спираловидна хирални
Спирална хиралност характеристика на съединения с елементи под формата на спирала или винтово витло, например helicenes [11]. Шест ароматни пръстени в geksagelitsene не могат да се срещнат в една и съща равнина, така че да образуват една спирала, които могат да бъдат усукани наляво или надясно. Този тип на хиралност наблюдава в протеини и нуклеинови киселини.
Топологичните Хиралността
Топологична хиралност поради наличието на структурна асиметрия характеристика на supramolecules. например, catenanes. rotaxanes. молекулни единици [6].
Хиралност съединения с електронна двойка стереогенен
Амините. фосфин. йони, сулфониеви, оксониева, сулфоксиди хиралност може да възникне поради пространственото среда на азотни атома. фосфор. сяра и кислород. Въпреки факта, че в тези съединения имат само три заместници, четвърто координация мястото на заема неразделен двойка електрони и е появата на хирален център.
Хирални амини различават от хирални кислородни съединения на фосфор и сяра като енантиомери амини, възникващи поради стереогенен азотен атом, рядко могат да бъдат разделени, тъй като те са лесно се превръща в един от друг поради инверсия на азотния атом (изчислено ЕА активиране енергия за триметиламин е около 30 ккал / мол). В същото време съответните фосфини са подложени на инверсия много бавно (изчислено активиране енергия ЕА за триметилфосфин е около 190 ккал / мол) [12]. Изключение от тази функция са амини където инверсията на азот е невъзможно, тъй като неговата конфигурация е пространствено фиксирана, като например в основата Trogera (Eng.).

Хиралност в неорганична химия
Много комплекси имат хирални. Classic в тази област са произведенията на Вернер. 40 се синтезира оптично активни координационни съединения. Например, комплекс с осмостенно бипиридин рутений [Ru (bipy) 3] 2+ е хирален, като три бипиридин лиганд в него заемат хирална конструкция във формата на перка.
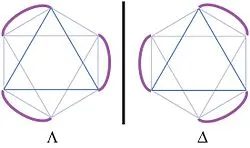
Комуникация с оптичната активност
Хирални съединения и техните решения имат способността да въртят равнината на равнинно-поляризирана светлина, която може да се наблюдава с помощта на поляриметър. Поради тази причина, хирални съединения също са посочени като оптично активна. или оптично активна.
А светлинна вълна преминава през разтвора оптично активно вещество, могат да бъдат написани като дясната и лявата кръгово поляризирани компоненти, които са в хирална среда разпространяват с различни скорости фаза. поради което има въртене на плоскостта на поляризация на светлината [13].
Хиралността по биология
Много биоактивни молекули притежават хиралност, с естествени аминокиселини и захари са представени в природата предимно като единичен енантиомер. аминокиселини главно имат L-конфигурация, и захари - г -конфигурация [14].
Двете енантиомерни форми на молекулата обикновено имат различна биологична активност. Това се дължи на факта, че рецептори. ензими. антитела и други елементи на организма също проявяват хиралност и структурното несъответствие между тези елементи, и хирални молекули предотвратява тяхното взаимодействие. Например, ензими. са хирални молекули, често проявяват специфична реактивност по отношение на един от енантиомерите. Подобни примери също са характерни за лекарствени съединения. По този начин, биологична активност притежава само един енантиомер на ибупрофен - (S) - (+) - ибупрофен, докато неговия оптичен антипод (R) - (-) - ибупрофен е неактивни в организма [15].
С редки изключения, природни хирални аминокиселини и монозахариди са представени като единичен изомер на два възможни. По този начин, в състава на протеини са почти изключително л амино киселини, и ДНК и РНК са конструирани само на база -uglevodov г. Това свойство на химични съединения, наречени хомохирална (хирална чистота). Произхода и предназначението на това явление не са инсталирани до края, но това често е свързана с проблема за произхода на живота [16].