Химически феноли каталог
Имена феноли нагоре като се има предвид факта, че в продължение на родителя в съответствие с правилата на структурата IUPAC запазва тривиално наименование "фенол." Номерирането на въглеродните атоми на бензенови пръстени започне от атом, директно свързан към хидроксилна група (ако е по-голямо функция), и продължава в разположение на заместителите за най-малък брой последователност. Монозаместен фенолни производни, като метилфенол (крезол), могат да съществуват под формата на три структурни изомери - орто - мета - и пара-крезол.
Физични свойства. Феноли вече - с кристално вещество (мета-крезол - течност) при стайна температура. Те имат характерен мирис, а слабо разтворим във вода, но са лесно разтворими във водни алкални разтвори. Феноли образуват силни водородни връзки и имат относително висока точка на кипене.
Методи за polucheniya.Poluchenie халогенобензени. При нагряване на хлоробензен и натриев хидроксид под налягане получава натриев фенолат, в по-нататъшната обработка на който киселината образува фенол:
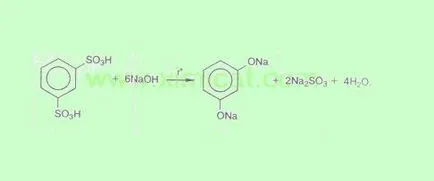
Получаване на ароматни сулфонови киселини. Реакцията се извършва при сливане на сулфонова киселина с алкален. Първоначално образува phenoxides лекувани със силни киселини за получаване на свободен фенол. Методът обикновено се използва за получаване на многовалентни феноли:
Химически свойства. феноли р орбитала на кислородния атом образуване на ароматния пръстен един р-система. Поради това взаимодействие, плътността електрон на атом кислород намалява и се увеличава в бензеновия пръстен. Поляритета ОН връзка се увеличава, и водородът на ОН групи стане по-реактивен и лесно заменя на метала дори под действието на алкален (за разлика от ограничаване едновалентни алкохоли). Освен това, в резултат на такова взаимно влияние в молекулата на фенол повишава реактивоспособността на бензеновия пръстен в орто и пара- положението в реакции електрофилно заместване (халогениране, нитриране, поликондензация, и т.н.)
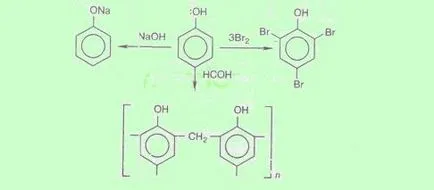
Киселинните свойства се проявяват в реакциите на фенол с алкален (запазен древен име "карболовата киселина"):
Фенол, обаче, е много слаба киселина. При преминаване през фенолати въглеродни или серни газове, освободени фенол разтвор - като реакция pozyvaet фенол - по-слаба киселина от въглена и серниста:
Киселинните свойства на феноли атенюирани, когато се прилага в пръстен I вид на заместители и заместителите са подобрени, когато се прилага род II.
Образуването на естери. За разлика от алкохоли, феноли не образуват естери когато са изложени на карбоксилни киселини; за тази цел, хлорал хидриди киселини:
Халогени. В действие на фенол бром води утайка от 2,4,6-tribromophenol (качествен реакция за откриване на фенол)
Нитриране. Под действието на 20% фенол азотна киселина той лесно се превръща в смес на орто - и ал -nitrofenolov. Ако фенол се нитрира с концентрирана азотна киселина, образуваната 2,4,6-тринитрофенол - силна киселина (пикринова).
Окисление. Феноли лесно се окисляват дори под действието на кислорода от въздуха. По този начин, за оставяне на въздух фенол постепенно се превръща розово-червен цвят. При енергично окисление на фенол хромат основен продукт на окисление е хинон. Дихидриран феноли се окисляват по-лесно. При окисляването на хидрохинон, хинон оформен.