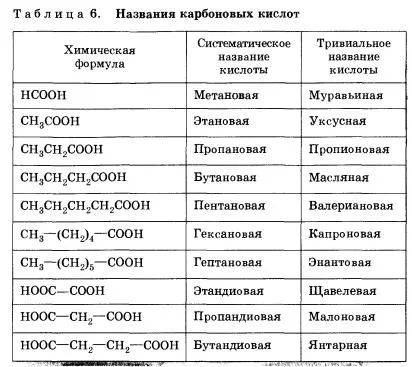
граница на имота карбоксилна киселина
Карбоксилни киселини съдържат карбоксилна група -СООН. киселинни свойства се определят от природата на радикала R, обикновено слаба киселина, рН = 4-5. Името се получава от съответния въглеводород с добавяне на затваряне "-vaya киселина" или затваряне "карбоксилна киселина", за да въглеводород на атом по-малко:
R = Н - метан киселина, мравчена киселина;
R = СН 3 - етанолова киселина, metankarbonovaya киселина, оцетна киселина;
R = C 2H 5 - пропанова киселина, etankarbonovaya киселина, пропионова киселина;
R = C 6H 5 - бензоена киселина, фенил карбоксилна киселина;
R = (С 6Н 5) 3C - трифенил оцетна киселина.
1. дисоциация да образуват водородни катиони и аниони на киселинен остатък. По-точно, този процес е описан от уравнение като се вземе предвид участието на водните молекули.
равновесие карбоксилна киселина дисоциация се измества наляво, по-голямата част от тях - слаби електролити. Очевидно е, че присъствието в молекулите на карбоксилни киселини "кисел" водород, т. Е. водородът на карбоксилната група поради други характерни свойства.
2. Взаимодействие с метали. стои в електрохимичната напрежение серия на водород. По този начин, желязо възстановява водород от оцетна киселина:
2СН3-COOH + Fe -> (CHgCOO) 2Fe + Н2
3. Взаимодействие с основни оксиди за да се образува сол и вода:
2R-COOH + СаО -> (R-COO) 2Ca + Н20
4. Взаимодействие с метални хидроксиди за образуване на соли и вода (неутрализация реакция):
R-COOH + NaOH -> R-COONa + Н20 3R-COOH + Са (ОН) 2 -> (R-COO) 2Ca + 2Н20
5. Взаимодействие със соли на слаби киселини. с образуването на последната. Например, оцетна киселина, стеаринова измества от натриев стеарат и калиев карбонат на въглища.
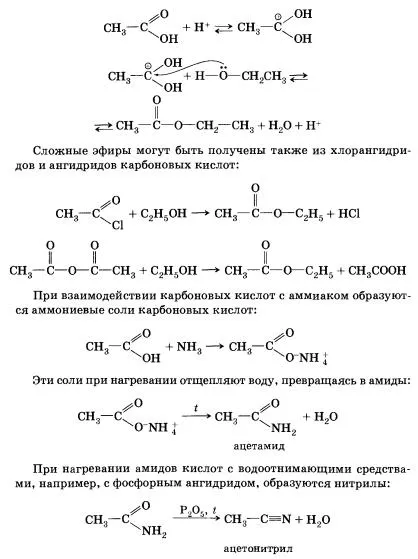
6. взаимодействие на карбоксилни киселини с алкохоли до образуване естери - вече известна реакция ете-rifikatsii (един от най-важните реакции характерни за карбоксилни киселини). Реакцията на карбоксилни киселини с алкохоли катализирани от водородни катиони.
Реакцията на естерификация е обратимо. Равновесие измества към образуването на естера в присъствие vodootni-бодното с инструменти и отстраняване на етера от реакционната смес.
Обратното реакцията на естерификация, който се нарича с естерна хидролиза (взаимодействие с вода на естера), киселина и алкохол се образуват. Очевидно е, че реагират с карбоксилни киселини, т.е., влиза в реакция на естерификация може и поливалентни алкохоли като глицерол ..:
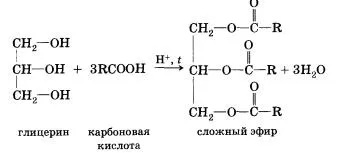
DCE карбоксилна киселина (с изключение на мравчена) заедно с карбоксилна група, съдържаща се в молекулите на остатък въглеводород. Разбира се, това не може да повлияе на свойствата на киселини, които се определят от естеството на остатък въглеводород.
7. Реакциите на свързване към двойната връзка - те идват ненаситена карбонова киселина; например, присъединителна реакция водород -gidrirovanie. Хидрогениране на олеинова киселина, стеаринова киселина, образувана ограничение.
Ненаситената карбонова киселина, както другите ненаситени съединения, халогени, свързани с двойна връзка. Така, например, акрилова киселина обезцветява бром вода.
8. заместващите реакции (халоген) - в него може да се присъедини пределната карбоксилна киселина; например, чрез взаимодействие с оцетна киселина хлор могат да бъдат получени от различни хлориран киселина:
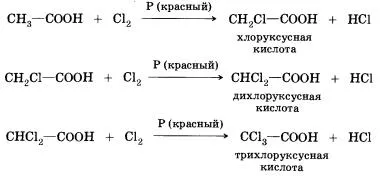
При халогенирането на карбоксилни киселини, съдържащи повече от един въглероден атом в остатък въглеводород могат да образуват продукти с различни позиции на халоген в молекулата. Когато реакцията протича чрез свободен радикален механизъм могат да бъдат заместени с всеки от водородните атоми в въглеводороден остатък. Ако реакцията се провежда в присъствието на малки количества от червен фосфор, е селективен - само водород е заместен в а-позиция (близкия към функционалната група на въглеродните атоми) в киселина молекулата. Причините за това селективност, ще научите в изучаването на химия в университета.
Карбоксилни киселини образуват различни функционални производни чрез заместване на хидроксилната група. Хидролизата на тези производни са новообразуваната карбоксилна киселина.
Карбоксилна киселина хлорид може да бъде получена на действието на киселинен хлорид, фосфорен (Ш) или тионилхлорид (SOSl2). Анхидриди на карбоксилни киселини се получават чрез взаимодействие на хлоро-анхидриди със соли на карбоксилни киселини. Естери, образувани чрез естерифициране на карбоксилни киселини с алкохоли. Естерификацията се катализира от минерални киселини.
Тази реакция ще започне протониране на карбоксилната група на - взаимодействие на водороден катион (протонен) от неразделен електронна двойка на кислородния атом. Протонизиране на карбоксилната група води до повишаване на положителния заряд на въглеродния атом в него:
Ако броят на въглеродните атоми във веригата не надвишава пет, то рязко миризма, подвижна и летлива течност. Над пет - тежки и мазни вещества, по - твърди восъчни.
Плътността на първите две членовете е по-голям от един. Всички останали по-лек от водата.
Точка на кипене: колкото по-високо от веригата, по-голям резултат. Колкото по-разклонена структура, така че по-долу.
Точка на топене: зависи от съотношение на броя на въглеродните атоми във веригата. Y е дори по-висока при нечетен долу.
Във водата, тя се разтваря много добре.
Са способни да образуват водородни връзки силни