Електрофилно присъединяване, електрофилно заместване
Electrophilic реакции. Механизъм електрофилно реакция е нуклеофилна атака на електрофил реакционно-ЛИЗАЦИЯ център на (N-център). Като такъв център в молекулата на под-слой често изпълнява множествена връзка (SP- или -gibridizovannye въглеродни атома), ароматен (бензол) ядро Тъй като в тези случаи има област на повишена плътност -electron.
Атакуване частиците - електрофил - може да доведе или от комуникация Heterolysis, например :. или поляризация ковалентна връзка близо до N-център. В последния случай, се образува така наречената индуцирана (или по-REFERENCE) дипол :.
Електрофилно присъединяване (AE). Има две оси novnyh механизъм на електрофилно присъединяване реакции.
1. бъде сложен механизъм. Тази реакция път се характеризира предимно при присъединяването неполярен и ниско полярни вещества до съединения, съдържащи въглерод-въглеродна двойна връзка-позиция. Да разгледаме пример за реакция механизъм връзка на брома на съоръжението. Обогатен с електрони в реакционната център lyarizuet бром молекула, като го електрофилни свойства; активен комплекс се образува междинно съединение - цикличен bromonievy йон. Етап I е лимитиращи скоростта стъпка protses SA на. След това бързо ще атака нуклеофилни частици на противоположната страна (така наречената antiprisoedi грижи), поради пространствено пречене, поради по-скоро голям размер на бром (етап II). За повторно действие характеристика на кисел катализатор, включително катализа кисел Tami Люис:
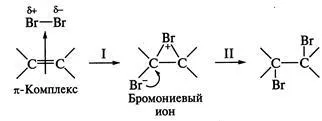
2. carbocation механизъм. Такава маршрут реакция се осъществява с полярни частиците на присъединяване (Hhal, и др.); Реакционната Limit-ал-етап е двойно протонирането на Con-съобщението (стъпка I) за образуване на carbocation с последващо бързо рояк нуклеофилна атака частици () до електрон дефицитни въглероден атом (етап II)!; например, добавяне на НВг:
Реакция nestereospetsifichna. Когато се присъедини халогениди тяхната реактивност (реакционна скорост) SNI-zhaetsya измежду: HI, HBr, НС1, HF.
хидратация реакция (реакция на присъединяване на вода) са скосяващ-loviyah катализа киселина. Киселини форма по време на йонизация йони, които имат твърде слаба нуклеофилно имот-E :. Получената carbocation протонирането нуклеофил нападнати - молекула вода - с образование-niem alkiloksonievogo йон. Последно стабилизиран чрез отделяне на протон в резултат на О-Heterolysis H-prois ходи "връщане катализатор", реакцията е обратима. Свържи се с Риа-- предим- катализирана дехидратиране на алкохоли, киселини:
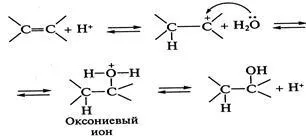
образуване Alkiloksonievogo йон е етап, ограничаващ скоростта на реакцията. Освен това, реакцията може да протече при π - сложен механизъм, в който се образува активиран комплекс в първия етап:
и който режисира нуклеофилна атака - водните молекули.
Помислете два възможни начина за присъединяване към бромоводород да пропен:
Електрофил атака в посока влияе главно от два фактора.
1.Pereraspredelenie електронна плътност -връзките събуждане Следствие положителен индуктивен ефект на околната среда (метали план група):
За предпочитане атакува електрофил въглероден атом с розово-shennoy електронна плътност, т.е. реакцията ще пристъпи на първия път.
2.Ustoychivost образува карбокатиони. Получената атаката на първия път vtorichnyy.karbkation е по-стабилен от основно - атака продукт електрофил на втори път. Дори по-голяма стабилност
притежават третични карбокатиони.
Следователно, влиянието на тези два фактора води до образованието на NIJ-2-бромопропан (първи път). Накратко, този механизъм се определя от правилото В. Markovnikov.
Когато прикрепена към асиметрични алкени полярен реагент HX тип частица електрофилно протон (Н +) е прикрепен към хидрогенирано въглероден атом, и анионът X - - по-малко от хидрогенирано въглероден атом на двойната връзка.
Скоростта на реакцията се влияе от структурата subjets-он м. Е. Близо реакция център среда. По този начин, електрон-отдаваща заместители повишаване скоростта на реакцията, облекчаване TH-чай присъединяване (увеличаване на електронната плътност в центъра на реакция) и електрон-отнемане заместителите SNI-zhayut реакционната скорост, което прави трудно електрофилно присъединяване. Намаляване на скоростта на реакцията се осъществява в серия:
Конюгиране повишава реактивоспособността на въглерод-въглеродна двойна връзка в отношение от електрофили и съответно правителствени увеличава скоростта на реакцията. Процесът продължава през последователните етапи, свързани с формиране на carbocation, тъй като тя се стабилизира чрез заплащане делокализация:
Протонизиране е втори път, тъй като в този чай SLE оформени конюгиран тип система алилов дължи на взаимодействие взаимно електрон дефицитни въглеродния атом, с - електрони на двойната връзка:
Алилови carbocation е активен електрофилно алкилиращ агент в живите организми. На изместването на електронната плътност при образуването на конюгирани система определя две възможни посоки на нуклеофил атака:
Така, реакционната смес образува produk-Ing 1,2-допълнение (втори път) и 1,4-допълнение (Vy на пътека), съставът на които зависи от реакционните условия.
Съединенията с тройна връзка, съдържащ въглеродни атоми, в състояние на хибридизация обикновено е по-малко реактивни в реакции. В резултат на протониране карбо-катион - vinilkation - е ниска стабилност. В етап депротониране оксониеви йони в резултат на изместване на тавтомерно равновесие (кето-енолна тавтомерия) се образуват оксо съединение (кетон):
Electrophilic реакции на заместване (SE). За ароматни бензен радват geterotsik и кондензиран ароматен кристал отговор характерен електрон-rofilnogo смяна.
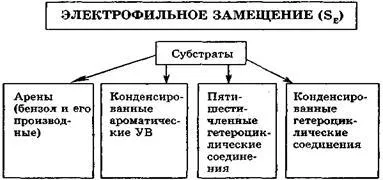
Характеристика SE реакции е, че атакува реагент - електрофил - се формира на реакцията на първи етап в присъствието на Lewis киселина (реакция на халогениране, алкилиране и ацилиране по Friedel-Crafts), или при киселинна катализа (алкилиране на алкени и алкохоли, нитриране), например:
Получените атаки на частиците на електрофилно нуклеофилен център - бензеновия пръстен. В резултат на атаката образува нестабилна структура (комплекс _L U) с начупена кръгла система конюгиране. Това е етап на ограничаване (етап I). Стабилизиране на структурата става чрез разцепване на про-тон комплекс _L U до образуване на крайния продукт.
Чрез този механизъм (SE) от по-горе изброените под-слоеве се процедира нитриране реакция, сулфониране, алкилиране, халогениране, ацилиране.
1. Получаване на електрофилни частици - нитрониев йон (NO2 +):
2. Образованието π комплекс _L U:
бензен π-комплекс
3. Образование # 963; комплекс _L U
π - комплекс # 963; - комплекс
Най- # 963; комплекс _L U един въглероден пристъпи към състояние SP 3 хибридизация, ароматност е счупен, комплексът е нестабилна и стабилизирането му става чрез SELECT-SA Н +.
4. Образуването на нитробензен:
5. NSO + Н + → H 2SO 4 (регенерация катализатор)
Ефект върху реактивността на заместители в SE
Монозаместен бензенови изомери имат, но ако има заместители на пръстен, симетрията на пръстена Naru Schönau на чрез квантовата-механични изчисления е установено, че всички заместители са разделени в две групи:
Някак електрон-донор (ED) - с изключение на халоген. Те увеличават електронната плътност на пръстена, особено в позициите орто и пара. Те включват: ОН; -NH2. -СН3. , -О-R; -NHR; CI; Br; I. Вид изпратих заместник новопристигнали групи в орто и пара позиция
Електрон род II (ЕА); те намаляват електронната плътност на пръстена, особено в позициите орто и пара. Те включват заместители имат в своята част от двойна връзка, като по този начин има π-π-конюгиране :. , -SO3 Н, -NO2; -S≡N; Заместителите II род е насочено пристигането група в мета позиция
По този начин, както в случая на реакции на скоростта на реактивност и СКО реакция се влияе от структурата на субстрата, Е. Бамя напрежение реакция център т.е... По този начин, електрон-отдаваща заместители (+ I-, М + ефект) увеличава електронната плътност на бензолното ядро, в резултат на реактивността на растеж субстрат; електрофил такива заместители са ориентирани в реакциите в орто -, двойка позиция (орто и пара - orientant или транс-orientant първия вид). Електрон привличаща заместители (-М ефект) за анти-намаляване на електронната плътност на бензеновия пръстен, което намалява реактивността на реакционната центъра на субстрата; ориентирани електрофил като заместители в мета позиция - (мета -orientanty или orientant втория вид).