Електродите и потенциала
Електродите и потенциала
Важна част от съвременната химия е електрохимията, която изучава процесите, протичащи в граничните-проводящ метали с течности или газове. В тези процеси трябва да участват заредени частици, йони и електрони. Електрохимия е от голямо практическо значение: Получаване и пречистване на метали, прилагането на защитни покрития, производство на метални копия, получаването на редица химикали (алкален, хлор и много други), изграждането на химически източници на ток - всичко въз основа на електрохимически процеси
Електроди. Електрод електрохимията нарича система, в която проводим материал се поставя в електролитния разтвор или стопилка или в газа. Твърдият метал (под формата на парчета, плочи, тел, прах, единичен кристал) на течния метал (живак, метални стопилки, живак амалгамите сплави), различни съединения (оксиди, карбиди и т.н.) могат да бъдат използвани като проводим материал, неметални материали ( въглерод, графит и т.н.), полупроводници.
Най-простият пример от метал, поставен в този воден разтвор на метална сол; той се нарича електрода 1 от първи вид.
Да разгледаме този пример: медна плоча се потапя в разтвор на меден сулфат (II). Солта във воден разтвор дисоциира в йони:
SuS04 ---> Си2 + + SO4 2-
На потапяне на блюдото в разтвор могат да се появят двата процеса: преходен метал мед с повърхностните атоми в разтвор (процес на окисление):
Cu - 2е ---> Си2 +:
и възстановяване на метални йони: Си2 + + 2е ---> Cu
Обикновено двата процеса се провеждат едновременно, но скоростта на един от тях в началния момент по-дълго. Много бързо (част от секундата) скоростта на двата процеса са подравнени и равновесие е установено между металните йони в разтвор и метал:
Си2 + + 2е ---> Cu
Така, ако електродът не осигурява външни влияния, е системата за равновесие.
Към електродите 1 от втория вид са всички видове системи Me Z + + Зе ---> Me (където Ме-метал, Z-зареждане на металните йони), както и системи с амалгама електроди; амалгама (метал разтвор на живак) -йони метал. Например, цинк амалгама на цинкови йони:
Zn2 + + 2е ---> Zn (Hg)
Има и други видове електроди. Ако металният слой се прилага разтворим негова сол или оксид и се поставя в разтвор, съдържащ йони на сол (за оксид йони ОН-), след това системата ще електрод 2 от първи вид. Например, сребро покрити със сребърен хлорид AgCl филм и поставени в разтвор на калиев хлорид е сребърен хлорид електрод. равновесие е установен в такава система:
AgCl + д <---> Ag + Cl -
Обща електрод на втория вид е каломелов електрод, както е показано на фиг. 1 За производството на такава система се излива живак (1) в стъклен съд, поставен върху него живачен хлорид (2) (каломел) - и се излива разтвор на калиев хлорид (3). Чрез измерване система прикрепен към метал контакт електрод (4), който се потопява в живак.
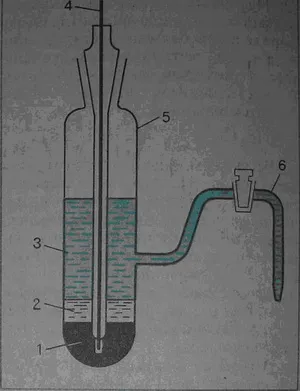
Фиг. I. каломелов електрод 1 живак-2-каломел, 3-разтвор на калиев хлорид, 4-метален контакт, стъклената контейнера 5, 6-сол мост
равновесие каломелов електрод е установено:
HG2 С12 + 2е<=> 2 Hg + 2 Cl -
Някои материали (платина, графит) се наричат инертна, така че те не могат да изпращат йони в разтвор. Тези материали се използват за редокс или редокс електроди COS-Дания. Например, платина плоча потопен в разтвор, съдържащ желязо сулфат (II) сулфат и желязо (III). В тази система, Fe2 + йони ще подход инертен метал и даряват електрони да:
Fe 2 + - д ---> Fe + 3
Йоните Fe3 +, доближавайки метал Bu FLS приемам електрони от него:
Fe 3 + + д ---> Fe + 2.
В този електрод е установено равновесие:
Fe3 + + д <--->Fe + 2
Самостоятелно материал, инертен електрод в една система на равновесие приема само непряко участие - е проводник на електрони.
равновесие на редокси на електрода може да участва по-голям брой частици. Например, ако платинов електрод се потапя в подкислен разтвор на калиев перманганат, равновесието е установено:
МпОг - 4 + 8Н + + 5e ---> М + п + 4H2 2 0
Специален тип редокс електроди са elektrdy газ, в която една от активните вещества е газ. Пример електрод газ - водороден електрод: платина, на капки в разтвор, съдържащ водородни йони Н + (разтвор на киселина), чрез който водороден газ
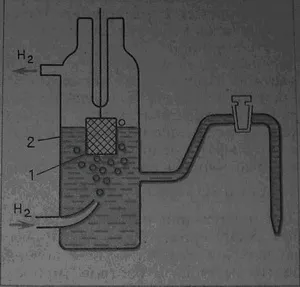
Фиг. 2. рН електрод: платина 1, 2- киселина
Общият баланс на такъв електрод се изразява чрез една опростена схема:
2Н + + 2е ---> Н2
Помислете за по-подробно на веригата. Молекулно водород, минаваща през течност, разтваря и разтворът на повърхността на платина (1). На повърхността на метала възникне разпад молекули на атоми и техните адсорбция (свързване на повърхността). Атомите на адсорбирания водородни са йонизирани Hads:
Hads -e ---> Н +
и водородни йони, като електроните преминават в адсорбирано състояние:
Следователно, пълно равновесие в електрод водород се изразява верига
2Н + + 2е ---> Н2
Всички тези видове електроди са окислително-редукционни системи, въпреки че името (редокс електроди) е само част от тях. Така че, в системата
Cu2 + + 2е ---> Cu редуцирана форма, или редуциращ метал е мед, и окислена форма или окислител - медни йони Си2 +.
Системният AgCl + E ---> Ag + Cl - окислена форма - AgCl, и възстановен - Ag + CI -; водороден електрод на водородни йони се окисляват форма газообразен водород намаляване и т.н.
Често се използва стандартната практика в електрохимични електроди като стандарт водород. Действието на тези електроди се извършва при стандартни условия: температура 298 К (25 ° С), налягане от 101 325 Ра (° или 760, или 1 атмосфера ..) и концентрациите на всички компоненти в разтвора I мол / L.
В промишлеността, графитни електроди често се използват