Електрически ток в електролити

Начало | За нас | обратна връзка
Електролити наречени проводяща среда, в която потокът на ток се придружават от прехвърляне на материала. носители Свободните зареждане в електролитите са положително и отрицателно заредени йони. За много електролити са съединения на метали с металоиди в стопено състояние, както и някои от твърдите вещества. Въпреки това, основните представители на електролити са широко използвани в областта на техниката са водни разтвори на неорганични киселини, соли и основи.
Преминаването на електрически ток през електролита придружено от отделяне на вещества на електродите. Това явление се нарича електролиза.
Електрически ток в електролита е движението на йоните на двете знаци в противоположни посоки. Положителните йони се движат към отрицателния електрод (катод) и отрицателни йони - положителен електрод (анод). йони на двете признаци се появят във водни разтвори на соли, киселини и основи в резултат на разцепване на неутрални молекули част. Това явление се нарича електролитна дисоциация. Например, меден хлорид, CuCl2 във воден разтвор дисоциира в йони и мед хлор:
В много случаи, електролизата се придружава от вторични реакции на продуктите от разлагането се развили в електродите. Един пример е електролиза на воден разтвор на меден сулфат CuSO4 (меден сулфат) в случая, където електродите се спуска в електролита, изработен от мед.
Дисоциацията молекули меден сулфат се осъществява съгласно схема
Неутрални медни атоми са депозирани като твърда утайка върху катода. Това прави възможно да се получи химически чиста мед. Ion анод дава два електрона и става неутрална радикал SO4 влиза вторична реакция с меден анод:
Получената молекула меден сулфат преминава в разтвор.
По този начин, чрез преминаване на електрически ток през воден разтвор на меден сулфат се разтваря меден анод и отлагане на мед върху катода. Концентрацията на разтвор на меден сулфат не се променя.
електролиза закон е създадена експериментално от английския физик Майкъл Фарадей на през 1833 година. закон на Фарадей определя броя на първични продукти, пуснати на електродите по време на електролиза:
Маса m вещество еволюира в електрода е пряко пропорционална на Q. на зареждане преминава през електролита:
Стойността на к се нарича електрохимичен еквивалент.
Мас еволюира на електрод материал равна на масата на йоните дойде на електрода:
Тук m0 и q0 - масата и отговаря на йона, N- брой йони дойде електрод при преминаване през електролита заряд Р. Така, електрохимичната еквивалент к е съотношението на йонна маса m0 на веществото за заряда q0.
Тъй като заряд на йон е продукт на валентността на веществото на п начално зареждане Е (q0 = NE), експресията на електрохимичната еквивалент на к могат да бъдат написани като
Тук NA - Авогадро номер, М = m0 NA - моларната маса на веществото,
F = ENA - Фарадей постоянна.
F = ENA = 96 485 С / мол.
Фарадей константа е числено равно на заряда, който трябва да премине през електролита да се разделят на електрода на един мол от моновалентна вещество.
право на електролиза на Фарадей става:
електролиза явление се използва широко в съвременното индустриално производство.
§21. Електрически ток в газове
В естествено състояние газ - изолатор. При нормални условия в газа са почти няма свободни носители зареждане, движението на които би могло да създаде електрически ток.
За да стане povodyaschim газ, е необходимо да се създаде свободни заредени частици, т.е.. Е. конвертиран неутрални молекули (или атоми) в йони.
Газ-диригент - е йонизиран газ.
Йонизация gaza.- това разпадане на неутрални атоми или молекули на положителни йони и електрони чрез разделяне на електрони от атоми. Йонизация се осъществява чрез нагряване на газ или излагане на радиация (UV, рентгенови лъчи, радиоактивни) обяснява разпад на атоми и молекули от сблъсък при високи скорости.
Процесът се придружава от йонизация на газа е винаги срещуположно това неутрален процес молекули възстановяване на противоположно натоварени йони, поради тяхната електрическа (Кулон) привличане. Този процес се нарича рекомбинация на заредени частици.
газ престане да бъде средство, ако йонизация спира, това се дължи на рекомбинация (Реюнион противоположно заредени частици).
газоразрядни - е електрически ток в йонизирани газове. зареждане носители са положителни йони и електрони. изпускането на газа се среща в разряд тръба (тръби), когато са подложени на електрическо или магнитно поле.
Има отделен газов разряд и не-себе си.
Освобождаване от отговорност съществува само от външния йонизатор, се нарича зависима изпускане на газ.
Зависимостта на тока в газа на приложеното напрежение се нарича волт-амперна характеристика.
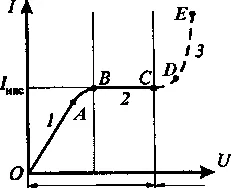
С увеличаване на напрежението, първичните електроните се ускоряват от електрическо поле, започват шок йонизиране газови молекули, образуващи вторични електрони и йони. Общият брой на електрони и йони ще се увеличи в електрони приближаващи анода на лавина. Това води до увеличаване на ток към част от CD. Описаният процес се нарича въздействие йонизация.
напрежения в значителни положителни йони също печелят достатъчно енергия за йонизиране на газовите молекули, което води йонни лавини. текущи увеличава силата са почти без увеличаване на напрежението (сегмент DE).
Един лавина умножение на електрони и йони води до факта, че освобождаването става независима. т.е. Тя продължава и след прекратяването на външния йонизатор. Напрежението при което газоразрядни възниква независимо наречен разбивка напрежение.
Електрически проба газ - преход отговорност несобствен газ в независима.
Независим газоразрядни byvaet4 вида:
1.tleyuschy - при ниско налягане (няколко Torr) -nablyudaetsya в тръби светят газоразрядни (флуоресцентна светлина) и газови лазери.
2.iskrovoy - при нормално налягане и висок интензитет на електричество поле (мълния - ампераж до стотици хиляди ампери).
3.koronny - при нормално налягане в неравномерно електрическо поле (на върха, теча на енергия).
4.dugovoy - голяма плътност на тока, ниско напрежение между електродите (температура на газа в дъга канал -5000-6000 градуса по Целзий); наблюдава в проектори, проекция видео техника, заваряване, живачни лампи.
При достатъчно ниски температури, всички вещества са в твърдо състояние. Нагряването предизвиква преход от твърдо в течно, а след това и газ.
След това нагряването резултати в йонизация на газ от сблъсък на бързо движещи атоми и молекули. Веществото в нов щат.
А плазма - четвърто състояние на материята с висока степен на йонизация поради сблъскване на молекулите с висока скорост при висока температура; се срещат в природата: йоносферата - слабо йонизирана плазма, слънцето - напълно йонизирана плазма; Изкуствен плазма - в газоразрядни лампи. Плазмата е:
Основни плазмени свойства: - висока електрическа проводимост - силно взаимодействие с външен електрически и магнитни полета.
99% от материала във вселената - плазмата.
Electron емисии - феноменът на електрон на емисиите от метали с електронна енергия на съобщението, равна на или по-голяма работа функция.
електрон работа функция на метала - работата, която трябва да бъде изразходвана за отстраняване на електрона от метала в вакуум.
Функцията за работа зависи от химическата природа на метала и чистотата на тяхната повърхност.
Функцията за работа се изразява в електронволта (EV). 1 ЕГ е дело, което направи за напрегнатостта на полето по движеща елементарен електричен заряд между точките, между които потенциалната разлика е 1 V. Тъй като е = 1,6-10- 19 Cl, след това 1 ЕГ = 19 J 1,6-10-.
1. катод емисии - излъчване на електрони нагряват метали. Пример за приложение - вакуумни тръби.
2. фотоемисионна - излъчване на електрони от метала под действието на електромагнитно лъчение. Пример -fotodatchiki използване.
3. вторичен електрон емисия - електронен емисии повърхността на метали, полупроводници или изолатори при бомбардиране с къса електрони. Съотношението на вторични електрони за броя на първичния n2 n1, причинени емисии, коефициент на емисиите, наречена вторична електрон # 963; = N2 / N1. Пример за приложение - фотоумножителни тръби.
4. поле емисии - излъчване на електрони от метални повърхности от действието на силно външно електрическо поле.