Електрически ток в електролити е физика
Електролити наречени проводяща среда, в която потокът на ток се придружават от прехвърляне на материала. носители Свободните зареждане в електролитите са положително и отрицателно заредени йони. Като електролити включват много съединения на метали в стопено състояние, както и някои от твърдите вещества. Въпреки това, основните представители на електролити са широко използвани в областта на техниката са водни разтвори на неорганични киселини, соли и основи.
Преминаването на електрически ток през електролита придружено от отделяне на вещества на електродите. Това явление се нарича електролиза.
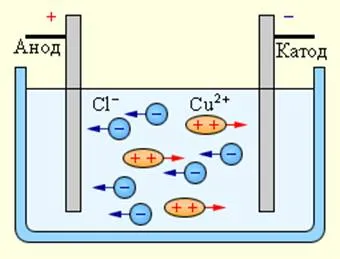
Електрически ток в електролита е движението на йоните на двете знаци в противоположни посоки. Положителните йони се движат към отрицателния електрод (катод) и отрицателни йони - положителен електрод (анод). йони на двете признаци се появят във водни разтвори на соли, киселини и основи в резултат на разцепване на неутрални молекули част. Това явление се нарича електролитна дисоциация. Например, меден хлорид, CuCl2 във воден разтвор дисоциира в йони и мед хлор:
При свързване на електродите на настоящите йони източник под електрическото поле започва подредени движение: положителни медни йони се движат към катода и отрицателно заредени йони хлорид - към анода (фигура 1.15.1).
При достигане на катод и медни йони се неутрализира чрез излишните електрони от катода и се превръща в неутрални атоми отлагат върху катода. Хлорните йони достигащи анода, един електрон е дадено. След неутрални хлорни атоми са свързани по двойки за образуване хлор молекула Cl2. Хлорът освобождава анода под формата на мехурчета.
В много случаи, електролизата придружава от вторични реакции на продуктите от разлагането се разви в електродите, с материала на електродите или разтворители. Един пример е електролиза на воден разтвор на меден сулфат CuSO4 (меден сулфат) в случая, където електродите се спуска в електролита, изработен от мед.
Дисоциацията молекули меден сулфат се осъществява съгласно схема
Неутрални медни атоми са депозирани като твърда утайка върху катода. Това прави възможно да се получи химически чиста мед. Ion анод дава два електрона и се превръща в неутрален радикал SO4 влиза вторична реакция с меден анод:
Получената молекула меден сулфат преминава в разтвор.
По този начин, чрез преминаване на електрически ток през воден разтвор на меден сулфат се разтваря меден анод и отлагане на мед върху катода. Концентрацията на разтвор на меден сулфат не се променя.
Маса m вещество еволюира в електрода е пряко пропорционална на Q. на зареждане преминава през електролита:
Стойността на к се нарича електрохимичен еквивалент.
Мас еволюира на електрод материал равна на масата на йоните дойде на електрода:
Тук m0 и q0 - масата и отговаря на йона, - броя на йоните, които идват в електрода, когато преминават през електролита заряд Р. Така, електрохимичната еквивалент к е съотношението на йонна маса m0 на веществото за заряда q0.
Тъй като заряд на йон е продукт на валентността на веществото на п начално зареждане Е (q0 = NE), експресията на електрохимичната еквивалент на к могат да бъдат написани като
Фарадей константа е числено равно на заряда, който трябва да премине през електролита да се разделят на електрода на един мол от моновалентна вещество.
право на електролиза на Фарадей става:
електролиза явление се използва широко в съвременното индустриално производство.