дисоциация на вода
Чистата вода е много лош проводник на електрически ток, но все още има измерима електрическа проводимост, което се обяснява с частично разпадане на молекулите на Н2 О на водородни йони и хидроксилни йони:
Големината на електропроводимостта на чиста вода може да бъде изчислена концентрация в него на Н + йони и ОН -. При 25 ° С е равно на 10 -7 мол / л.
Константата на дисоциация на Н 2О се изчислява както следва:
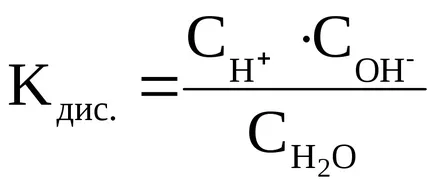
Ние пренапише това уравнение:
Трябва да се подчертае, че тази формула се състои от равновесните концентрации на Н2 О молекули, йони Н + и OH -. са установени по време на равновесието на дисоциация на Н2 О.
Но тъй като степента на дисоциация на Н2 О е много малък, може да се приеме, че концентрацията на недисоциирана молекули на Н 2О в момента на равновесие е практически равна на общата първоначалната концентрация на вода, т.е. 55,56 мол / дм 3 (1 дм 3 Н 2О съдържа 1000 г Н2 О или 18, 1000. ≈ 55,56 (мола). Може да се приеме, че концентрацията на N2 О ще бъдат същите в разредени водни разтвори. Следователно, замествайки в уравнение (42) продуктът от две константи

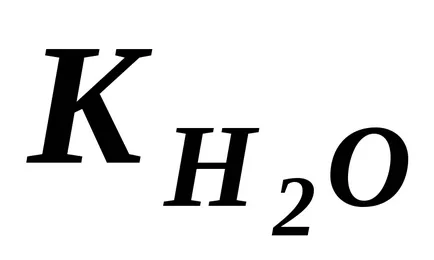
Получената уравнение показва, че за вода и водни разтвори се разрежда при постоянна температура, продукт на моларните концентрации на водородни йони и хидроксилни йони е постоянна. Тя се нарича различна йонна продукт на вода.
В чиста вода при 25 ° С Следователно, температурата е посочено:
Чрез увеличаване на стойността на температурата
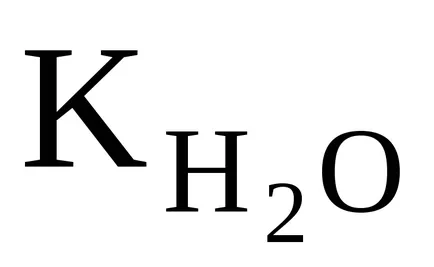
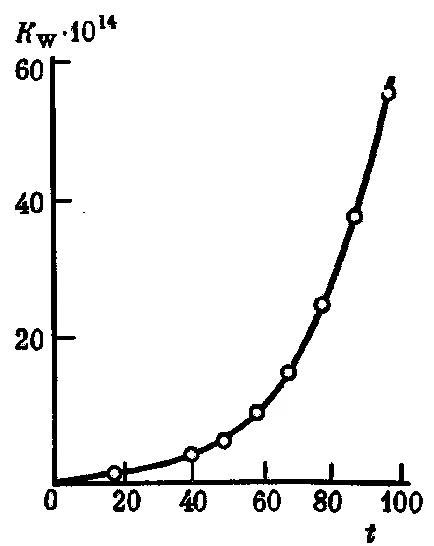
Фиг. 34. Зависимостта на вода дисоциационна константа KW на temperaturyt (° C)
Разтвори, в които концентрацията на Н + йони и ОН-идентични nazyvayutsyaneytralnymi решения. Vkislyhrastvorah вече съдържа водородни йони и хидроксилни йони vschelochnyh-. Но независимо от реакционната среда в разтвора, продуктът на моларните концентрации на Н + и OH - остава постоянна.
Ако, например, да се почисти Н 2О се добавя определено количество киселина и концентрацията на Н + йони след това ще се увеличи до 10 -4 мол / дм 3 концентрация на ОН - йони съответно намалява така, че продуктът на

На практика, за количествени характеристики на киселинност или алкалност на разтвора не се използва в това моларната концентрация на Н + йони. и неговия отрицателен логаритъм. Този индекс стойност nazyvaetsyavodorodnym и означен cherezrN:
Например, ако рН = 2; ако рН = 10. неутрален разтвор рН на = 7. В кисела рН разтвори <7 (и тем меньше, чем «кислее» раствор, т.е. чем больше в нём концентрация ионов Н + ). В щёлочных растворах рН> 7 (и по-голяма "алкален" разтвор, т.е. по-малко от това на концентрацията на Н + йони).
Има различни методи за измерване на рН на разтвора. Много добро реакционният разтвор приблизително оценена с помощта на специални реагенти наречени киселина базови показатели. Покритие на тези вещества в разтвора варира в зависимост от концентрацията на това в Н + йони. Характеристики на някои от най-често използваните показатели са представени в таблица 12.
Таблица 12. Най-важните показатели киселина базови