Белтъчната
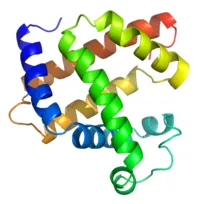
Структурата на протеини - 3-измерна структура на миоглобина с подчертани а-спирали.
Протеинови молекули са линейни полимери, съставени от 20 основни аминокиселини (които са мономерите) и, в някои случаи, на модифицираните основни аминокиселини (въпреки модификации появят след синтеза на протеини в рибозомата). За да се отнасят до аминокиселини в научната литература се използват единични или трибуквени съкращения.
Аминокиселинната последователност на протеина съответства на информацията, съдържаща се в гена на протеина. Тази информация е представена в форма pocledovatelnosti нуклеотиди, където една аминокиселина отговаря на една или повече последователности на три нуклеотиди - така наречените кодони или триплета. Това, което съответства на дадената аминокиселинна кодон на се определя от генетичния код на иРНК, която може да бъде малко по-различно в различни организми.
Краищата на С- протеин и N- нарича край (в зависимост от които групи на крайната амино киселина е свободна (не участват в образуване на пептидна връзка): -СООН или -NH2, съответно.). Когато протеиновата синтеза на рибозомата, нови аминокиселини, свързани с С-края. Протеини с дължина от 2 до 100 аминокиселинни остатъци често се отнасят като пептиди с високи степени на полимеризация - протеини, въпреки etodelenie доста конвенционален.
Нивата на протеинова структура

Освен последователността (първична структура) е от решаващо значение триизмерната структура на протеина. Тя се формира по време на сгъване (от английски език. Сгъване, т.е. сгъване). Има четири нива на протеинови структури:
- последователността на аминокиселинни остатъци в полипептидната верига.
Протеин вторична структура се състои от местната асоциация на фрагменти. Там са показани две: лилаво разпределени spril α, Р слоеве жълти и бели региони без вторична структура.
- местно секвениране фрагмент полипептидна верига, стабилизиран чрез водородни връзки и хидрофобни взаимодействия. По-долу са някои често срещани мотиви протеин вторична структура:
- пространствена структура на полипептидната верига - взаимното разположение на вторични структурни елементи, стабилен взаимодействие между страничните вериги на аминокиселинните остатъци. Стабилизирането на третичната структура са включени:
ковалентна връзка (между два цистеина - дисулфидни мостове);
йонно (електростатично) взаимодействие (между противоположно заредени аминокиселинни остатъци);
- субединица протеинова структура. Взаимното разположение на няколко полипептидни вериги в рамките на един протеинов комплекс.
Протеин и РНК синтез
РНК, която носи информация на първичната структура на протеинови молекули, синтезирани в ядрото. След преминаване през порите на ядрената обвивка, и РНК-насочено към рибозомите, където генетичната информация извърши справка - Я от "език" на нуклеотиди в "език" на аминокиселини. Аминокиселините от които са синтезирани протеини, се доставят на рибозомите, използвайки специално РНК, наречен транспорт (тРНК). Т-РНК е комплементарна на нуклеотидната последователност от три нуклеотида кодон и РНК. Такава последователност на нуклеотиди в структура, наречена тРНК антикодон. Всяка т-РНК специфични присъединява "тяхната" амино киселина, използвайки ензими и с разходите на АТР. Това е първият етап на синтеза. За аминокиселината участва във веригата на протеин, той трябва да се откъснат от т-РНК. Във втората фаза на синтеза на протеини тРНК носи преводач функция с "език" на нуклеотиди в "език" на аминокиселини. Такова прехвърляне се извършва в рибозомата. Тя включва две части: една тРНК получава команда от иРНК - антикодон признава кодон в другия - поръчката е изпълнена - амино киселина се отделя от тРНК. Третата стъпка е синтеза на протеин, който придава на разкъсване синтетаза ензим на тРНК аминокиселина до нарастващото протеин молекула. РНК непрекъснато се плъзга върху рибозома, всеки триплет, първо влиза в първата част, в която се разпознава тРНК антикодон, след това втората част. Това се отнася и тРНК с амино киселина, прикрепен към нея, се отделя от аминокиселината тРНК и свързани един с друг в последователността, в която триплети следват един от друг.