азотна киселина
азотна киселина
Азотна киселина - много важно и необходимо съставка, важен минерална киселина. Чрез общата продукция това дава само сярна киселина. В промишленото производство се използват две разновидности:
- Разреден (съдържа 50-60% HNO3);
- Концентрирана (съдържа 96-98% HNO3).
Азотна киселина е практически вода от въздуха с амоняк. Всички компоненти на внимателно филтрира и почиства от примеси, както твърда и газообразна.
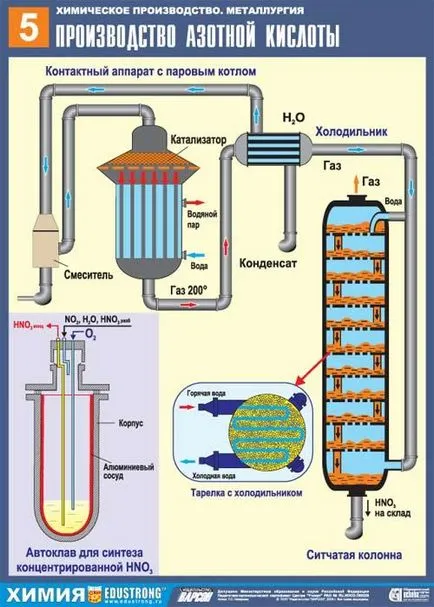
Modern химическата промишленост произвежда азотна киселина чрез каталитично окисление на амоняк с кислород, съдържащ се във въздуха. Използването на катализатор позволява да се получи НЕ, лесно се превръща в NO2. И това, от своя страна, във връзка с вода в присъствието на резултатите кислород в азотна киселина. Катализаторът в този случай се основават на платина сплави.
В резултат на това се получава производство на азотна киселина, чиято концентрация не надвишава 60%. Процесът се извършва преди концентрацията на 97-98% и така наречените "димяща" азотна киселина. При температури под 41С се превръща в безцветно вещество на кристалната структура.
Информацията азотна киселина
Азотна киселина активен и дори агресивен окислител на органични и неорганични вещества. Интересното е, че в разредена форма, той се окислява всички метали с изключение на платина, сребро, родий и иридий, буквално разтваря желязото! Състоянието, в концентрирана азотна киселина passivates метали. На металната повърхност, тънък, но издръжлив слой оксид, който не се разтваря и допълнително защитава метала от корозия. Концентрирана азотна киселина е много токсичен и излъчва токсични газове (азотни оксиди) във въздуха. Концентрирана азотна киселина трябва да се съхраняват в запечатан контейнер на хладно и тъмно място, тъй в светлината и под влиянието на топлина частично разгражда!
Азотна киселина от гледна точка на практиката
Той е част от протеини и други биологични гледна точка.
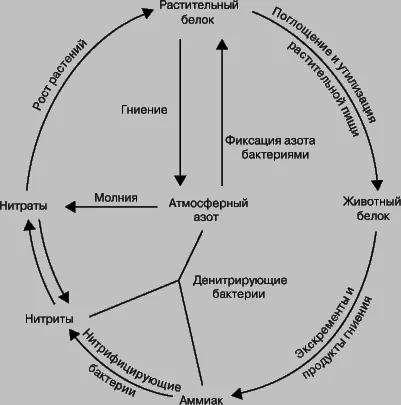
Приблизително половината от азотната киселина е за азотни торове. Азот - необходими за живота и развитието на растенията елемент. Но в свободна форма, тя е недостъпна за растенията и може да се метаболизира изключително от тях под формата на соли за азотна киселина, нитрати, наречени. Под азотна земя доставка в почвата постепенно се изчерпват и изисква попълване. От азотна киселина се получава тор наречен нитрат. Най-популярни от тях - натрий (или чилиецът) нитрат и калиев нитрат.
Освен торове се използва азотна киселина за получаване на разнообразие от синтетични багрила и nitrovarnishes. Той се използва за производство на пластмаси и взривни вещества, както и медикаменти и за производство на сярна киселина като окислител гориво в ракета инженерство и т.н.