Ароматни Krugosvet енциклопедия
ароматен
Ароматни Съединения - комбинация от определени свойства, присъщи на една голяма група от съединения, наречени съответно ароматен.
Терминът "Ароматността" е въведена през 1865 г. F.Kekule. определи структура бензен и предложи формула за това:
Наименованието "ароматен" е свързано с факта, че има съединения с приятен мирис сред бензенови производни (например, бадемово нитробензен има аромат).
Кекуле обръща внимание на факта, че двойните връзки в бензол и неговите производни се различават значително в свойства на двойните връзки в повечето ненаситени съединения. Бензен са изключително трудно реакция на свързване (например, халоген) за двойни връзки, които са сравнително лесно в случай на ненаситени съединения.
Освен това, беше установено, че орто -dihlorbenzol (хлорни атоми са в два съседни въглеродни атоми) няма изомери, които може да се очаква въз основа на предложеното структурна формула за него, където двата Cl атоми са разположени в или единична или двойна връзка:
В резултат на това Кекуле препоръчва именуване комуникация в бензен колебания, т.е. колебания. С течение на времето, това предположение е доразвита и е подобрена.
Най-характеристика на реакционната бензен заместване на водородни атоми. Изследване Chemistry бензен показа, че заместване на водороден атом на всяка отделна група, и, преди всичко, предвидим ефект върху реактивността на останалите водородните атоми.
Ако ядрото бензен да въведе група дърпа електрони от ядрото (например, метил), последващо халогениране води до заместване в орто и пара позиция. Когато се прилага elektronopodayuschey групи (например, карбоксил) халоген ръководи в мета-позиция:
За дълго време ароматност счита набор от определени химични свойства, но по-точни указания, въз основа на особеностите на структурата на ароматни съединения бяха открити постепенно.
Електронната структурата на бензен и сродни съединения в съвременния смисъл е както следва. При образуването на двойните връзки участват п електрони въглеродни атома орбитали (в региона най-вероятно местоположение на електрона в пространството) на електрони са под формата на насипни осмици. В случай на бензен орбиталната vzaimoperekryvayutsya образуване орбитален пръстен, в който са разположени всички р-електроните на молекулата:
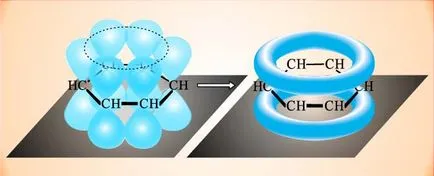
Резултатът е един затворен електрони обвивка, системата придобива висока стабилност. Фиксирани единични и двойни връзки в бензен липсват, всички от С-С средно и са еквивалентни, така че често се използва за обозначаване на ароматността на символа на пръстен, поставен във вътрешността на линия:
В резултат циклични орбитите настъпва пръстеновиден ток, който може да бъде открит чрез специални измервания, по-нататък показваща ароматност съединение.
Има ароматност равнинни циклични молекули с броя на електроните (т), комбинирани в единична пръстенна система, трябва да отговаря на правилото на Huckel:
м = 4п + 2 (п = 0, 1, 2, 3), п - брой на естествени числа
По-долу са показани първите три представителя на редица ароматни молекули, съответстващи на правилото на Huckel: циклопропен катион. бензен и нафтален.
Разширяването на понятието "ароматност" оставя да се прилага този термин до съединения nebenzolnogo тип, но като в същото време набор от структурни и химически разполага характеристика на бензенови производни.
В някои съединения, където част от цикъла са атоми от О, S или N, като например фуранил, тиофенил, пиролил като бензен съществува постоянна - в съответствие с правилото на Huckel - shestielektronnaya затворена система. Четири електрон р- (маркирани в синьо на фигурата) осигурява двойно цикъл връзки и два електрона S- (маркиран червено) произвежда кислород, сяра или азот като свободна двойка електрони.
Ароматни може да бъде не само планарна циклични молекули, но също така и обемисти структура, например, сандвич молекула (фероцен dibenzolhrom.) И някои рамкови борани:
В случай на насипни конструкции вместо на Huckel правило се прилага различни правила за определяне на броя на електроните, което се случва, когато ароматна структура. Въпреки това, във всички тези случаи има ароматност основни функции: затворена електрони обвивка, висока стабилност на молекулата, склонността към заместване реакции и ефекта на въвеждане на заместител на реактивността на други реактивни центрове в молекулата.
Garrett P. общо органичната химия. на. от английски език. М. 1981
Ohlobystin О. Животът и смъртта на химически идеи. М. 1989