Анодно разтваряне - химически енциклопедия
Анодно разтваряне на метала. електрохимична. окисляване на метала в р-D или стопен електролита за образуване на р - разтворими продукти и отнемане на освободените електрони във външен. верига. Най-общо казано, този процес може да се запише по следния начин. по следния начин:
където М е метален атом. п-брой освобождават електрони. В съответствие с правото на Фарадей. . И т.н., в отсъствието на зависимостта на р-електродни ции между скоростта на окисляване на метал V [г / (см 2 * и)] и плътност на анодна ток и е от вида:
Анодно разтваряне е в основата на електрохимична двумерен. обработка на метали и техните сплави, и electropolishing, втвърдяване анод метален блок. материал от отстраняване на тънък Повет механично деформирани. слоеве се използва р - разтворим анод по време на електрохимичната. рафиниране на метали и галванопластика. Чрез анодно разтваряне в средства. EXP-зависима luatats. галванични характеристики. клетки и батерии. както и поведението на корозия на конструкцията. метален блок. материали.
Най-важните характеристики на анод-разтваряне и зависимостта на на електрод потенциал Е и частна производна обратен връзката. обади. поляризуемост и е tehn. характерни разтварящи аноди. Тези зависимости могат да бъдат концентрация. или кинетична. (Активиране) характер. Който случай не се прилага на практика това зависи от отношенията между аз и Е за дадена текущия валутен IO. т.е. плътност на тока в потенциала на равновесие, когато той е точно равен на плътността на тока на обратния процес - катодна метал отлагане. за аз
където Е - стандартната потенциал електрод. [М + Н] - под-повърхност концентрация на метални йони. Т абе. температура, R-газ постоянна. Въпреки това, останалата равновесие потенциал варира, тъй [М + Н] у-STI превързочни увеличава пропорционално на скоростта на анодно разтваряне (т.е., Аз, плътност на тока). Съответно. зависимост от Е на Ур-е описано Niemi:
където K - емпирични. коефициент. Това Ур-комплект МБ Това е счупено, когато се достигне лимита на р-rimosti сол. образувана с един метал от анионите на електролита. и [М] престава да расте. Ако получената утайка е свободно и не значително се предотврати преминаването на ток, допълнителният метал е почти не-поляризиран. Такъв, например. естеството на не-поляризиран otritsat. оловни батерии плочи.
В водни електролити р-ма поляризуемост описано концентрация. Типове характеристика на преходни метали от групи I и II (Ag, Cu, Zn, Cd), за очи характеристика IO-високи стойности. Неговата най-важна характеристика - зависимостта на Е не само аз, но и от интензивността на смесване р-па.
Когато бях> IO постъпленията разтваряне с кинетична. контрол, т.е. Тя се ограничава електрохимична. стъпка - прехвърляне на заредените частици през метал-RR и скоростта му варира с потенциал Е на закона:
някъде така. обади. коефициенти. трансфер. Този тип поляризуемост особено характеристика на група VIII преходни метали (Fe, Ni, Co и т.н.), притежавани до характеризира с ниски стойности на IO.
На етап ограничаване, а оттам и на целия процес може значително да повлияе на предходния етап на адсорбция и химически. взаимодействие. повърхност метални атоми с компонентите на R-ра (р-erator молекули, електролитни аниони). С оглед на този етап и механизма на скоростта на анодно разтваряне може да бъде изразена както следва:
където А - е адсорбирания компонент г-ра, и m е броят на молекулите. участващи в процеса, K1 - константа. В зависимост от условията на адсорбция може да стимулира или инхибира анодно разтваряне (т т. Б. положителен или отрицателен). Съответно. прилагане на RR или отстраняване от него на компонентите на адсорбираните - един от най-ефективните методи за регулиране на скоростта на разтваряне на анода в областта. Стимулантите са широко използвани в двумерен електрохимична технология. метали. както и за намаляване на поляризуемост разтворими аноди. Използване на инхибитор на разтваряне на анода - един от най-важните методи за защита от корозия метали (виж инхибитори на корозията.).
Анодно разтваряне. притежавани до крайни продукти са мултивалентни катиони или комплекси от него, протича обикновено чрез серия от един електрон стъпки (N - 1), всеки един от които в зависимост от условията могат да бъдат ограничаващи. В същото време, межд. метални йони с ниска степен на окисление е често dookislyayutsya не само стационарно състояние (понякога по-малко) електрохимично, но също така и в резултат на директно взаимодействие. с окиси. R-ра компонент (разтворен кислород молекули. H + йони), например. на р-ТА:
В такива случаи, общият процент на анод разтваряне може значително да надвишава стойността, изчислена по текущата единственият.
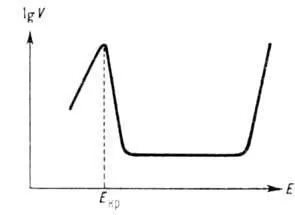
Често усложнява от вторични явления анодна разтваряне. По този начин, образуването на превързочни-STI разтваряне на металната фаза или адсорбция сол или оксид пасивиране слоеве води до анодно разтваряне (вж. Пасивност метали) към небето проявява в отслабването на скоростта му в зависимост от способността да се постигне разтваряне ограничаване плътност на тока. а понякога и да се променят в зависимост от вида. В водна среда се увеличава. склонност да се пасивира се различават повече. преходни метали (Mo, Cr, Ni, Fe и т.н.). Те се характеризират с критично. потенциал ECR. в зависимост от естеството на метала и рН на R-ра. При достигане Ecr процент увеличение обикновено анодно разтваряне се заменя от неговия остър ниска, понякога до няколко. порядъци. След това, в голям обхват от потенциални стойности на скорост анодно разтваряне се поддържа постоянна и след това започва да расте експоненциално с потенциал (вж. Фиг.). Последният феномен е известен като superpassivation, поради нов процес анодна (окисление на метални йони на високи валентности) до ING това в основата на електрохимична. технология за производство на по-висока Порт кислород. редица метали. напр. Mn, Cr. Когато сплав анодно разтваряне възможно неравномерно прехода на неговите компоненти в р-р, т.е. селективно разтваряне на някои компоненти и обогатяване на повърхността на слоя сплав друг.
===
App. Литература за статията "анодна разтваряне." Kolotyrkin YM "Природа", 1979 г., брой 11, стр. 2-13: сам, ".Zaschita Метали", 1983 г., 19 m, № 5, стр .. 675-85; Основи на теория и практика на електрохимична обработка на метали и сплави. М. 1981. JM Kolotyrkin.