Активатори и инхибитори на ензими
Активатори и инхибитори на ензими
Регламент на дейността на ензимите могат да бъдат ензими, чрез взаимодействие с различни биологични компоненти или чуждестранни съединения, които се наричат регулаторите на ензими. Те могат или да се ускори или забави ензимната реакция.
Aktivatory- са вещества, които увеличават скоростта на ензимната реакция.
1. Веществата, които засягат областта на активния център. Те включват метални йони (Na +. + К. Fe2 +. Co 2+. Си2 +. Са2 +. Zn 2+. Mg 2+. Mn2 +, и т.н.). В някои случаи, метални йони функционират като ензимен кофактор. В други случаи, те насърчават придържане на субстрата към активния център на ензима. Метални йони са активатори само от гледна точка на техния дефицит в организма.
2. Алостеричните манипулатори. които се свързват с алостеричен (регулиране) част апоензим. Това свързване причинява конформационни промени в протеиновата молекула, което води до промяна на активната структура сайт, което се отразява на превръщане на субстрата и свързване в активния център. Когато тази ензимна активност или повишени (това алостерични активатори) или намалява (което алостерични инхибитори). Алостеричните изпълнителни ензими обикновено са различни метаболити, както и хормони, метални йони, нуклеозиди - АТР, ADP, AMP.
3. Вещества, vyzyvayuschiemodifikatsii които не влияят на активния център на ензима. Има няколко възможности тези изменения:
- активиране чрез прикрепване специфични модифициращи групи за молекула ензим. Пример: липаза регулиране активност.
неактивна ATP ADP активен О
─SN2 ОН ─SN2 ─O─R─ON
В този случай, фосфатната група, прикрепена към хидроксилните групи на аминокиселини в протеина са част от ензима. Отрицателно заредените фосфатни групи могат да се счупят слаб водород и йонни връзки в третичната структура на ензима протеин и влияят на конформационен състоянието на неговия активен център. В зависимост от характера на ензима фосфорилиране може да я активирате, или алтернативно се дезактивира. Добавянето реакция на фосфатна група, катализирана от ензима протеин киназа. и разцепване - фосфатаза. Активността на тези ензими, от своя страна, се контролира от хормоналната система.
- активиране на неактивни прекурсори putomperehoda - проензим до активния ензим поради частична протеолиза.
Някои ензими са синтезирани в клетката първоначално неактивни след отделяне от клетките отиват в активна форма. Неактивни предшественици, наречени проензими (зимогени). Под действието на активатор настъпва проензим частична хидролиза с елиминиране на това неактивен пептид, при което се отваря активното място. Тъй като активирането на ензимите на стомашно-чревния тракт, смилането на храната протеини. Например, ензимът pepsinogen. синтезиран в клетки на стомаха, и след това в лумена на стомаха чрез действието на солна киселина се превръща в активен пепсина чрез изтриване неактивна част от полипептидната верига:
HCl неактивни активно
пепсин, pepsinogen + пептид
- активатор причини дисоциация ензимни подединици, които имат кватернерна структура (разцепването на един от субединици на ензима).
Ingibitoraminazyvayut вещество vyzyvayuschiesnizhenie ензимна активност. Ако се разграничат инхибиране и инактивиране на ензима. Фактът, че инхибиране на ензимната реакция в присъствието на вещество, все още се каже, че това вещество - инхибитор. Всички денатуриращи агенти причиняват инактивиране на ензим и инхибиране на ензимната реакция. Инхибитори, за разлика от денатуриращи агенти действат в малки концентрации и да предизвикат специфичен намаляване на ензимната активност.
По силата на свързващите инхибитори на ензима разделени на обратим и необратим. Необратими инхибитори свързват плътно към ензима, докато ензимен комплекс - обратим инхибитор чуплив. Ако силно разреден ензим разтвор с обратим инхибитор, техните сложни разлагане и ензимната активност се възстановява.
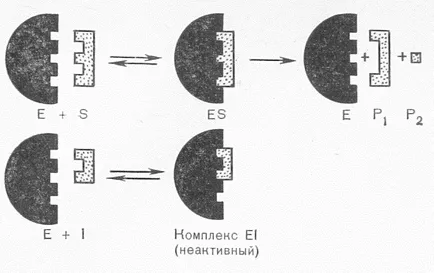
В механизма на действие на инхибиторите може да бъде разделена на конкурентни и неконкурентни. Конкурентни инхибитори са структурно подобни на молекулата на субстрат, който им позволява да заеме мястото на субстрата в активното място на ензима:
Поставяне вместо на субстрата в активното място, като инхибитор не позволява реакцията ензимната извършва. Това означава, че субстратът се конкурира с инхибитор на активното място. С активното място се свързва към съединението, чийто молекули повече. Премахване на конкурентно инхибиране може да бъде чрез увеличаване на концентрацията на субстрата.
На принципа на действие конкурентно инхибиране на базата много фармакологични агенти (например, сулфонамиди), инсектициди, органофосфорни бойни отровни вещества (зарин, Soman).
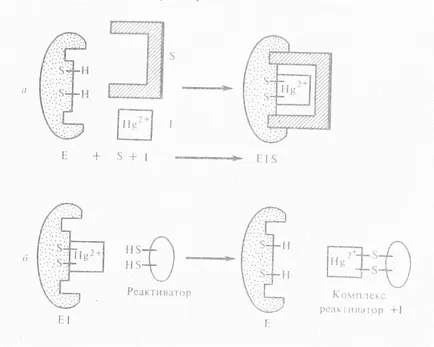
Неконкурентни инхибитори не са структурно сходство с основи. Те или се свързват с каталитичния център на ензимни активни групи, или чрез свързване с ензима активен сайт е, промяна на структурата на активното място така, че да предотвратява превръщането на субстрата. Като неконкурентен инхибитор не влияе на свързването на субстрата, за разлика от конкурентно инхибиране се наблюдава образуване на троен комплекс:
За не-конкурентни инхибитори включват йони на тежки метали: живак, олово, кадмий и арсен. Те блокират SH-групи в каталитичното място на ензима. Отстранете излишния ефект неконкурентен инхибитор на субстрата, като в конкурентно инхибиране, е невъзможно и може само вещества, свързващи инхибитор (реактиватор). Тежки метали само в ниски концентрации действат като инхибитори, във високи концентрации те действат като денатуриращи.
Най-важните неконкурентни инхибитори са произведени в жива клетка метаболитни междинни продукти, които могат обратимо свързване към алостерични места на ензима - алостерични инхибитори. Те заемат ключова позиция в обмяната на веществата, като едва доловимо реагира на промени в обмяната на веществата и регулира преминаването на вещества за цялата ензимна система. Например, алостеричен регулиране на инхибиране се изразява като краен продукт на първия ензим верига. Това регулиране е подобен на механизма за регулиране и обратна връзка позволява да се контролира крайния добив на продукта, в който случай натрупването се прекратява работата на първите ензимни веригите