6 карбонилни съединения, алдехиди и кетони - позоваване участник
Карбонилни съединения: алдехиди и кетони
6.1. карбонилна група
Функционалната група на алдехиди и кетони е група С = О - карбонилна група. група алдехиди карбонил е свързан с водороден атом и радикалът кетони имат две алкилови или арилови групи:

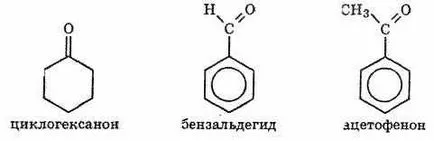
Общата формула на наситени алифатни алдехиди и кетони Cn H2N О. известни са също така циклични кетони (например, циклохексанон) с обща формула H2N-C п 2 О. Най-простият ароматен алдехид и кетон - бензалдехид и ацетофенон:
^ 6.2. Номенклатура на алдехиди и кетони
Имената на алдехиди и кетони са образувани от имена въглерод-водорода с еднакъв брой въглеродни атоми допълнение EUV -al фиксиране в имената на алдехиди и кетони в имената -он. Позицията на карбонилната група в кетони посочено lokan-
се поставя в предната част на -На наставка. Някои примери са дадени по-долу:
Метанал Н2 CO (формалдехид, мравчена алдехид)
СН3 СНО етанал (ацеталдехид, ацеталдехид)
С6 Н5 СНО Benzolkarbaldegid (бензалдехид)
СН3 СОСН3 пропанон (ацетон) (Фиг. 43b)
СН3 SOSHSN3 бутанон (метилетилкетон)
^ 6.3. Структура на карбонилната група
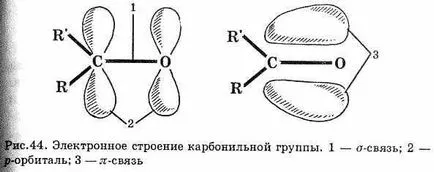
Група R2 С = О конструира при използване на три -връзки, лежи в една равнина, и връзки, образувани в резултат на припокриване-vanija р орбитали от въглеродни атоми и кислород (фиг. 44). Elek-О- престоли и облигации на карбонилната група е силно изместен към по-електроотрицателна кислороден атом. Това изо-карти начина:
Тъй -поляризирана връзка е по-силна от -връзка диполен момент на връзка С = О значително по-голяма, отколкото, например, C-Cl връзката. Благодарение на тази структура, алдехиди карбонилната група и кетони - високо реактивни вещества.
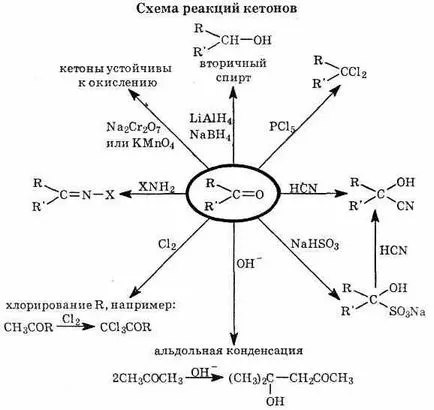
^ 6.4. Реакция с нуклеофили
Електрофилите и нуклеофили в органични реакции могат да се считат съответно като акцептори или донори на електрони двойки, като ги от едно благоприятно техните атоми или други атоми; тези въглеродни атоми са най-често у-leroda атома. Очевидно е, че нуклеофилно и електрофилно Риа-нето също може да се разглежда като специален случай на процеси оксидант-ционни и възстановяване, защото електронни акцептори са елек и нуклеофили - донори на електрони.
Нуклеофилно частици са привлечени към въглеродния атом на карбонилна група, носеща частичен положителен заряд. С приближаването на нуклеофил (например, CN -) -електроните на С = О все изместен към кислороден атом. Образуваният междинен кислороден атом, има отрицателен заряд-ти и въглеродният атом образува четири -връзка.
Нетният резултат на реакцията - присъединяване HCN Communications С = О). В общи линии, ако ние означаваме нуклеофил Nu, реакцията може да се запише по следния начин:
Реакциите от този тип се появяват като цяло е много по-лек от нуклеофилно заместване на наситени въглеродни атоми.
^ 6.5. Сравнение на алдехиди и кетони до алкени
Карбонилната група (С = О) група прилича на алкен С = С, така че да има и -връзка между два атома. Следователно, може да се предположи, че алдехиди и кетони, както и алкени реагират с електрофили като Вг2. HBr. Од-Нако не е така. Група С = О, за разлика OS група без прибавянето-обединяваща електрофилни реагенти. Така че:
^ 6.6. Кето-енолна тавтомерия
Тавтомерите - изомерите е различна структура, в динамично равновесие. За алдехиди и кетони се характеризира с феномена на кето-енол тавтомерия. Тавтомерните форми се различават Xia позиция водороден атом и ацетон, са изброени по-долу:
^ 6.7. Сравнение на алдехиди и кетони
Алдехиди - по-реактивен съединение от кето ни. Основната причина за това е, че присъствието на кетони в две алкилови групи, за да се създаде място за целия пречки подход на нуклеофил към карбонилната група (фиг. 45). А роля на електрон-донорни свойства на алкилови групи, което намалява частично-ти положителния заряд на въглероден атом роден.
^ 6.8. Методи за получаване
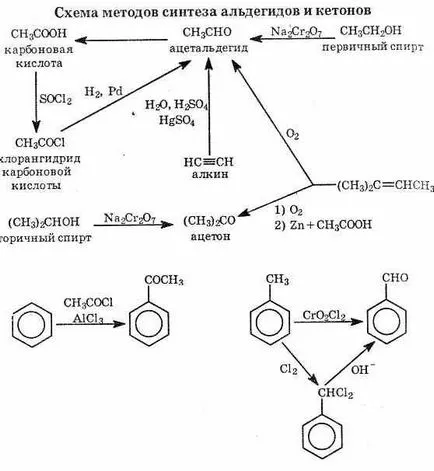
Хидратация на алкини в кисела среда в присъствието на соли на две-валентна живак. (Kucherov реакция). Ацетилен се превръща в ацеталдехид и други крайни алкини са превърнати в съответните метилови кетони.
Карбонилни съединения могат да бъдат получени чрез окисление на алкохоли. В този случай първичните алкохоли се окисляват до алдехиди и вторични - до кетони.
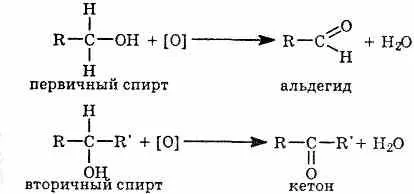
Формалдехид (МЕТАНАЛ), приготвено в промишлеността ката-литична окисление на метан.
^ 6.9. Физични свойства.
При обикновени условия на всички алдехиди и кетони, с изключение на формалдехид niem са течности или твърди вещества. Те имат по-ниска точка на кипене в сравнение с точки на кипене на съответните алкохоли, което се дължи на неспособността на карбонилни съединения до образованието на NIJ-водородните връзки.
По-ниските хомолози и средните стойности в редица алдехиди са характер Ню Йорк миризма. Приятен мирише по-високи алдехиди са широко използвани в парфюмерията.
Долна алдехиди (формалдехид, ацеталдехид) и кетони и ацетон) са лесно разтворими във вода.
^ 6.10. Химически свойства.
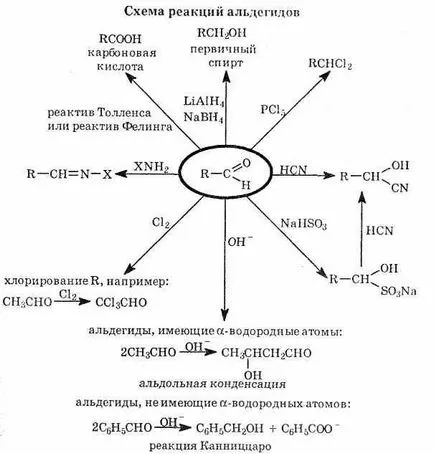
Наличието на карбонилната група в -връзка и поляризация-OCU slavlivaet характерните свойства на алдехиди и кетони (вж. §6.3.-6.5.). Благодарение на поляризация на С = О-полярен връзка в зависимост от типа на частиците Н-X се появява по-лесно в сравнение с въглерод-въглеродна двойна връзка.
Най-значителните разлики в химичните свойства на алдехиди от съответните кетони на свойства, свързани с розово-shennoy активност -водородни атоми, която е причинена от поляризацията на С-Н под електронен ефект консумация карбонилна група. Поради тази причина, добре окислява алдехиди, кетони, докато по-малко изложени на оксиданти.
Карбонилни съединения се редуцират до алкохоли в едър, литиево алуминиев хидрид, натриев борохидрид. Водородът се присъединява Communications С = О. Реакцията е по-трудно от хидро-нето на алкени: изисква нагряване, високо налягане и Ш-метален катализатор (Pt, Ni):
Алдехидите лесно се окисляват до карбоксилни киселини. Telyami-оксиди могат да служат като меден хидроксид (II), сребърен оксид, кислород от въздуха:
Ароматни алифатни алдехиди окисляват по-трудно.
Кетони, като посочените по-горе, е трудно да се окисли алдехиди. Окислението на кетони се провежда в тежки условия, в pricutstvii силни окислители. Образувана от смес от карбоксилни киселини.
* Как да се разграничи от алдехиди кетони?
Разликата в способността да се окисли е базисни качеството правителствена реакции, които позволяват да се разграничат от алдехиди кетони. Много меки оксиданти реагират лесно с алдехиди, но инертен към кетони.
а) Толенс "реагент (разтвор на амонячен сребърен оксид), комплексни йони, съдържащи [Ag (NH3) 2]. реакция с алдехиди дава "сребро огледало". Това образува метално сребро. Разтвор на сребърен оксид, приготвен непосредствено преди експеримента:
Толенс реагент окислява алдехиди до съответните карбоксилни киселини, които в присъствието на амоняк, за да образуват амониеви соли. самата окислител в тази реакция Reconstruct
navlivaetsya до метално сребро. За тънък NY посребряваше плаки върху стените на тръбите, които се образуват в тази реакция, реакция на алдехиди с амонячен разтвор на сребърен оксид се нарича реакция "сребро огледало".
СН3 -СН = О) 2 [Ag (NH3) 2] ОН-> СН3 COONH4 2Ag 3NH3 Н 2О 2. Алдехиди също намаляват съм miachny прясно приготвен разтвор на меден хидроксид (II), притежаващ светлина luboy ти цвят (разтвор на Фелинг ), меден хидроксид до жълт (I), който се разлага при нагряване, за да се освободи яркочервен утайка от меден оксид (I).
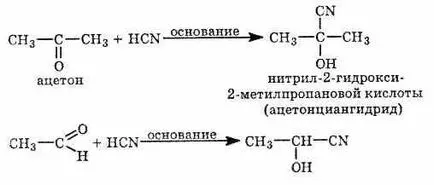
1) Реакция с tsianovodorodnoy (циановодородна) киселина. Циановодородът прикрепен към алдехиди и кетони, за да се образува цианохидрини карбонилни съединения. Реакцията се катализира с основа:
2) ^ Взаимодействие с вода. Вода се свързва към С-О:
3) Взаимодействие с алкохоли. Чрез взаимодействие aldegi-позиция с алкохоли може да се образува ацетали и полуацетали. Полуацетали са съединения, където, когато един въглероден атом има хидроксилна група и алкокси. Чрез ацетали включват вещества, чиито молекули съдържат ryh кото-въглероден атом с два месене алкокси-Titel.
Ацетали от алдехиди в контраст, са по-устойчиви на оксид-niju. Поради обратимостта на взаимодействие с алкохоли са често използвани в органичния синтез за "защита" Alde gidnoy група.
4) * Обединяване hydrosulfites. Хидросулфит NaHSO3 и се присъединява към съобщенията С = О, за да образуват кристален-то производно с карбонил съединение, което може да се регенерира. Използване на бисулфитни производни са на алдехиди и кетони пречистване.
5) ^ Обединяване на реагент на Grignard. Grignard реагенти за свързване-органомагнезиево съединение с обща формула R-Mg-X, където R - въглеводороден радикал, X - халоген. Те се получават чрез взаимодействие на
В реакцията на Grignard реагенти с карбонилни съединения и е продукт прибавянето съвместно хидролиза се получават следващите депозитите на алкохоли. По този начин чрез взаимодействие с кетони получава третични алкохоли
чрез взаимодействие с алифатни алдехиди с всички (с изключение на VOR maldegida) дава вторични алкохоли
и реакцията с формалдехид - първичен
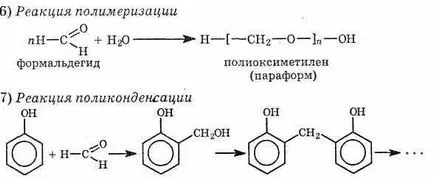
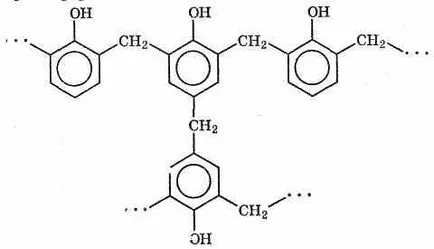
В резултат на поликондензация на фенол с формалдехид в присъствието на катализатори съгласно произвежданите фенол-формалдехидна смола, от която пластмасовите - фенолите (бакелит). Феноли - най-важните заместители на черни и цветни метали в много индустрии. От тях izgotav-Ливан голям брой потребителски продукти, електрически изолационни материали и конструктивни детайли. Frag-среда на фенол-формалдехидна смола е показано по-долу:
Изходните съединения за получаване на алдехиди и кетони могат да бъдат халогенирани въглеводороди, алкохоли и киселини.
^ 6.11. Използването на карбонилни съединения
Формалдехидът се използва за получаване на пластмаси, например, бакелит, кожа тен, дезинфекция, дресинг на семена. Съвсем наскоро, в нашата страна, ние сме разработили метод за получаване на депозити на полиацетал (СН 2-О). който има висока
химична и термична стабилност. Това е ценна CON struktsionny пластмаса, може в много случаи да замени метали.
Ацеталдехид се използва за производство на оцетна киселина и някои пластмаси.
Ацетон се използва като изходен материал за синтеза на съединенията комплект-GIH (например, метил метакрилат, който се получава чрез полимеризация на акриловата); се използва също като разтворител.