3 Скоростта на химични реакции
Реакциите могат да продължат с различни скорости. Скоростта на реакцията зависи главно от естеството на реагентите и реакционните условия (реагенти концентрации, температура, налягане и т.н.).
Реакциите се наричат хомогенна (еднофазна), ако реактивните молекули са в единична фаза (течно или газообразно състояние). Такива реакции се срещат в целия обем на системата и скоростта му е измерена промяна в концентрацията на едно от веществата, участващи в процеса, за единица време:
концентрация С се изразява в мол / л и времето т в минути или секунди, така че величината на скоростта на реакцията [мол / ls] или [мол / lmin].
Наречен хетерогенна реакция, ако реагентите са в различни фази. Те са в интерфейса където реагентите влизат в контакт, и скоростта им се измерва с броя n вещества. влизане в реакцията или образуван от реакцията за единица време на единица площ:
където S - площ. Размерът на хетерогенна реакция [мол / m 2 s] или мол / cm 2 s].
Скоростта на реакцията зависи от броя на сблъсквания между молекули на реагентите, което увеличава с тяхната концентрация. Zakondeystvuyuschih маса формулирани както следва:
При постоянна температура, скоростта на химична реакция е пряко пропорционална на продукта от концентрациите на реагентите в градуси, равни на коефициентите на уравнението на реакцията.
Към реакционната смес се пристъпи съгласно уравнение m A + B п = р C + р D, математически израз на закона за действие маса има формата:
където - скорост на реакцията;
[А], [В] - концентрация на реагенти А и В;
м. п - коефициентите в уравнението на реакцията;
к - постоянна скорост (в зависимост от температура и естеството на реагентите, но не зависи от концентрациите). Константата на скоростта е числено равна на скоростта на реакцията на реагентите в концентрации, равни на единство.
Когато хетерогенна реакция концентрация на веществата в твърда фаза, е постоянна и не се включват в експресията на закона за действието на масите.
Зависимостта от скоростта на реакцията на температура се определя pravilomVant Hoff. според която
където
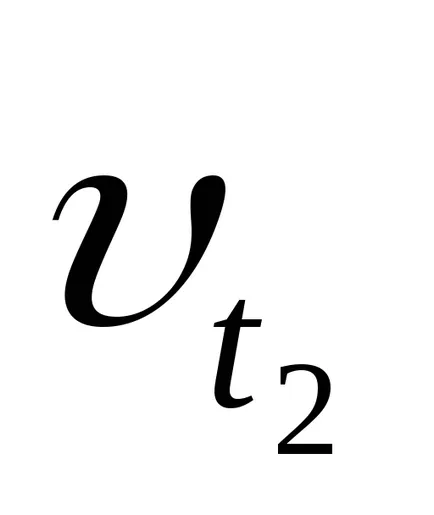
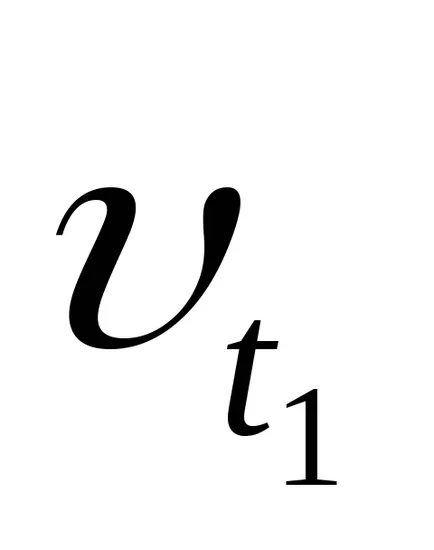
- температурен коефициент на скоростта на реакцията. Това показва колко пъти скоростта на реакцията се увеличава с повишаване на температурата от 10 градуса.
Минималната излишната енергия в сравнение със средната стойност, която трябва да има молекула на реакцията между тях става възможно, наречен енергия aktivatsiiEa. Изчислете своя уравнение Арениус, ако стойностите на скоростните константи
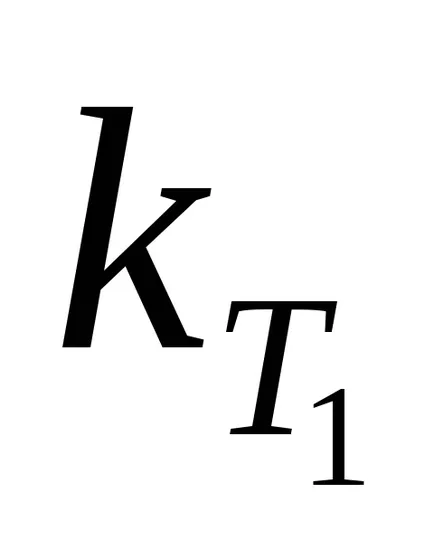

където R - универсална газова константа, равна на 8,32 J / molK.
Пример 1. Как да променя размера на реакция 2NO + O2 = 2NO2. ако обемът на газовата смес, за да се намали три пъти?
Означаваме на началните концентрации на реагенти [NO] = A. [O2] = б. Съгласно закона на маса скорост на реакцията действие е равно на изменението на обема = ка 2 б.
След намаляване на обема на хомогенна система е три пъти концентрацията на всеки от реагентите да се увеличи три пъти:
Съгласно новите концентрации на скоростта на реакцията:
Следователно, скоростта на реакцията ще се увеличи с 27 пъти.
Пример 2. Реакцията между вещества А и В протича през 2А + В = С началните концентрации са равни на уравнение [A] = 6 мол / л, и [В] = 3 мол / л. Константата на скоростта на реакцията е равно на 0,6 л 2 · мол -2 ∙ и -1. Изчислява се скоростта на реакцията в началния момент и момента, когато реакционната смес остава 40% от вещество А.
Такъв проблем, който се решава с помощта на таблицата в които допринасят С п - началните концентрации на вещества; C - тяхната промяна в хода на реакцията; С до - концентрацията на вещества в крайния времето, когато реакционната смес трябва да бъде 40% от материал, който е 6 0,4 = 2,4 мол / л. След промяната в концентрацията на веществото А е 6 - 2.4 = 3.6 мол / л. От уравнението на реакцията показва, че вещества А и В са взаимодейства в съотношение 2. 1, така че концентрацията на В намалява до S = 3.6. 2 = 1,8 мол / л и е равна на
Пишем закона за действието на масите за нашия отговор: = к 2 V A . Концентрациите на изходните материали са посочени в таблица:
Въз основа на определени начални и крайни концентрации от напред скорост на реакцията:
n = 0.6 3 2 юни = 64.8 мол / л с ; k = 0.6 2,4 2 1,2 = 4,15 мол / л с .
Изчислените резултати показват, че скоростта на реакцията намалява с времето, тъй като вещества, консумирани по време на реакцията.
Пример 3 Колко пъти се увеличи скоростта на реакцията с повишаване на температурата от 40 до 70 0 С, ако коефициентът на температура е равно на 2?
Според правилото на Van't Hoff,

Следователно, скоростта на реакцията ще се увеличи с 8 пъти.
Пример 4. Изчислява активиране енергия на реакцията, ако скоростните константи на 273 и 283 К съответно 410 5 и 810 5 1.
От Арениус уравнение енергията активиране:
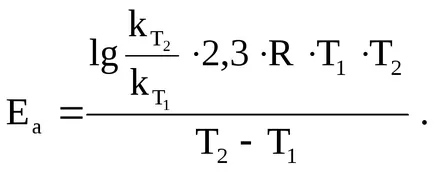
Заместването на данните, ние получаваме:
=
= 44353 J / мол = 44.35 кДж / мол.
41. Реакцията преминава от уравнение (ж) + 2С (ж) С (Z). Както скоростта на реакцията ще се промени, ако увеличението на налягане от 3 пъти и едновременно повишаване на температурата при 30 0 С? Температурата на коефициента на скоростта на реакцията е 3.
Отговорът: увеличение от 729 пъти.
42. реакцията протича съгласно уравнение 2А (ж) + В (г) 2С (G). Както скоростта на реакцията ще се промени, когато налягането в системата 2 пъти и в същото време понижаване на температурата до 40 0 ° С? Температурата на коефициента на скоростта на реакцията е 2.
Отговор: намален 128 пъти.
43. Скоростта на реакцията се увеличава 243 пъти, температурен коефициент е 3. В колко градуса е бил повдигнат на температурата?
Отговор: 50 0 С
44. Реакцията протича съгласно уравнението N2 + 3H2 2NH3. Както скоростта на реакцията ще се промени, ако концентрацията на азот се увеличава с 4 пъти, а концентрацията на водород - 2 пъти?
A: увеличава 32 пъти.
45. реакцията протича съгласно уравнение 2А (ж) + В (г) С началните концентрации на реагентите (мол / л): CA = 0,8; SV = 0.6. Както скоростта на реакцията ще се промени, ако концентрацията на веществото в увеличен до 0.9, и вещество - 1,2 мол / л?
Отговор: тя ще се увеличи с 3,4 пъти.
46. реакцията протича съгласно уравнение 2А (ж) + В (г) С началните концентрации на реагентите (мол / л): CA = 2,5; CB = 8. Както ще променят скоростта на реакцията, ако концентрацията на веществото А намалява до 1.5, и В - до 4 мола / л?
Отговор: намаление с 5.6 пъти.
47. разпадане на N2 О протича съгласно уравнението 2N2 О = 2N2 + О2. Константата на скоростта е равна на 5 ∙ 10 4 л / molmin. След известно време, концентрацията на N2 О се равнява на 3 мол / л. Какъв процент от разлагат N2 О, ако съотношението на крайната скорост е равна на началната 0.36? Каква е първоначалната скорост на реакцията?
А: 40%; 0,0125 мола / lmin.
48. Осапунването на ацетат изразява чрез уравнение:
SOOS2 H5 СН3 + NaOH SOONa СН3ОН + С2 Н5. Като се започне концентрация естер 0,02 мол / л, 0.1 мола алкален / литър. След известно време са реагирали 75% етер, и скоростта на реакцията става равна 4,2510 5 мола / lmin. Изчислява първоначалната скорост на реакцията.
Отговор: 2,010 4 мола / lmin.
49. Реакцията между веществата А и В се изразява чрез уравнение 2А + B С константа скорост от 0.7 L 2/2 мола min. Първоначалната концентрация на вещество В е равно на 0,6 мол / л. След 40% взаимодейства материал А. концентрация става равна на 0,3 мол / л. Вземете начална скорост и скоростта на реакцията по времето, когато 40% от взаимодейства вещество А.
А: 0.105; 0,0315 мола / lmin.
50. Реакцията между веществата А и Б протича съгласно уравнение 2А + B С началните концентрации на реагентите (мол / л): SA = 6; CB = 5. Константата на скоростта е равна на 0,5 л 2/2 мола s. Изчислява се процентът на химична реакция в началния момент и момента, когато 45% от веществото остава в реакционната смес.
Отговор: 90; 0,28 мола / ls.
51. реакцията протича съгласно уравнение (ж) + 2С (ж) С (Z). Както скоростта на реакцията ще се промени, когато налягането в системата 4 пъти и едновременно понижаване на температурата до 20 0 С? съотношение скорост температурата е 3.
Отговор: намаление от 576 пъти.
52. Реакцията протича съгласно уравнение 2А + B С Концентрациите на вещества А и В са равни на 0,5 и 0,1 мол / л. Изчислете константа скорост на реакцията, ако скоростта на реакцията е 510 3 мол / lmin.
А: 0.2 л 2/2 мола min.
53. Как да променя скоростта на реакция, протичаща в газова фаза, ако увеличението е три пъти: а) концентрацията на O2. б) концентрацията на солна киселина в) налягане?
Отговорът: увеличаване а) 3 пъти; б) 81 пъти; в) 243 пъти.
54. реакцията протича съгласно уравнението Н2 (д) + I2 (ж) 2NI (G). Константата на скоростта на реакцията е равна на 0,16 л / mols. Началните концентрации на веществата са (мол / л):
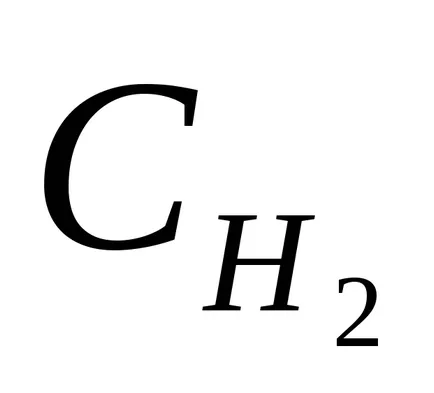
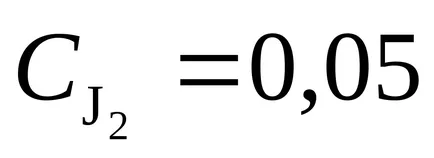

Отговор: 3,210 4; 1,910 4 мола / ls.
55. Реакцията протича съгласно уравнението А + 2В С константа на скоростта е равна на 0,4 л 2 / мол s 2 и първоначалната концентрация (мол / л): SA = 0.3; SV = 0.5. Изчислете скоростта на реакцията в началния час и след реагира 0.1 мол / л от съединение А.
А: 0.03; 0,0072 мола / ls
56. реакцията протича съгласно уравнението 2N2 О = 2N2 + О2. Константата на скоростта на реакцията е равна 510 4 л / molmin. Първоначалната концентрация на N2 О се равнява на 3,2 мол / л. Изчислява се скоростта на реакцията в началния момент и момента, в който се разлага 25% N2 О.
Отговор: 51,210 4; 28,810 4 мола / lmin.
57-60. На скорост на реакцията постоянно t1 при 0 ° С е равно на k1. и t2 0 ° С - k2. Енергията на активиране Ea кДж / мол. Изчислява се стойността, посочена по въпроса.