13 алкалоземни метали, берилий, магнезий, техните оксиди, хидроксиди и соли
Алкалоземни метали, берилий, магнезий: техните оксиди, хидроксиди и соли. Понятието органомагнезиево съединение
13.1. Общи характеристики на метали основните подгрупи на група II
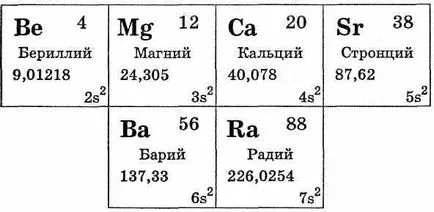
Основната подгрупа на група II включва берилий Be, Mg магнезий, калций Са, Sr стронций, барий Ba, радий Ra. От тези Kal-ции, стронций, барий принадлежат към семейството на алкалоземни метали (вж. Таблица. 29).
Това е-елементи. В типична прости метални вещества. Външно са два електрона. Даване тях, те проявяват степен на окисление на съединенията 2. В редокс реакции всички подгрупа метали държат като силни редуциращи агенти, но малко по-слаби от алкални метали. Това е така, защото металните атоми на група II имат малък атомен радиус от атоми Съответно vuyuschih-алкален метал, намиращ се в същите срокове. Това се дължи на някои компресия на електронен слой, като S-подниво на външния електронен слой са завършени, така че ти електрони ги направи по-съмишленик.
Физични и химични свойства на елементи на основната група II група
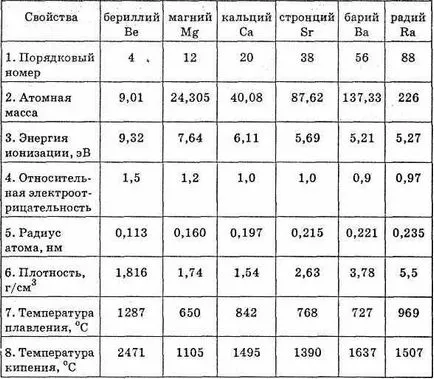
С увеличаване на поредния номер на електрони възвръщаемост на улеснено от, и следователно метални свойства на естествено СЗО-стопилка. По-ясно се срещат в алкална IU-талий.
Трябва да се отбележи, че в техните свойства, берилий и магнезий са малко по-различен от алкалоземни метали калций, стронций и барий (Група радий последния елемент се различава от други алкалоземни метали природни radioak-тивна свойства) на.
Калций, стронций и барий се окислява на въздуха до състав на RO оксиди, обаче те се съхраняват без достъп на въздух или germyl-чвателят затворени съдове, или под слой на етер или керосин. Берилий и магнезий при стайна температура на въздуха за kryvayutsya тънък оксид филм, който ги предпазва от по-нататъшно окисление. За тези метални оксиди е необходимо да ги изгори:
Калций, стронций и барий разлагат вода дори при обикновена температура, за да се образува съответния хидроксид и водород разделяне:
Хидроксиди на алкалоземни метали слабо разтворими във вода, разтворимостта се увеличава от Са (ОН) 2 на Ва (ОН) 2.
Берилий вода не взаимодейства, защото оформен в първата точка на умерено разтворими хидроксид на берилий филм Be (OH) 2 passivates метала. Берилий хидроксид Бъдете (OH) 2 има амфотерен характер:
Въпреки това, свойствата на Ве (ОН) 2, като основа, изразено по-ясно кисела.
Магнезиев реагира само с вода при нагряване:
Магнезиев хидроксид - типичен база.
При нагряване, всички метали основна група II групи реагират с активен водород (даващи хидриди RH2. Mi с халоген, сяра, азот, фосфор, въглерод.
От тази подгрупа метали най-важните са магнезий и калций.
^ 13.2. Магнезий и неговите съединения. органомагнезиеви съединения
Магнезий - много лек сребърен-бял метал. плътността му е 1,739 гр / см 3 - 1/3 по-малко от плътността на алуминий. По силата на алуминиево-магнезиев надвишава около 2 пъти. сплави на база магнезий, заемат едно от първите места в структурата на авиокомпанията.
Магнезият е доста устойчив на окисляване, тъй като въздух в kryvaetsya защитен филм. Магнезият е мощен Сун-stanovitelem. Ако магнезиев лентата за запалване, тя бързо CDF-raet с замаскиране флаш, разработване на топлина. Магнезиев се използва флаш фотография, в производството на ракети, при запалване термични смеси и т.н.
Когато магнезиев горене развива толкова висока температура, че дори да изгори до въглероден оксид (IV), той се разширява: 2 mg CO2 = 2MgO С
Магнезиев оксид MgO - бяло огнеупорен вещество, добре разтворим във киселини. То се нарича също магнезий, който се използва в производството на огнеупорни тухли, като точката му на топене е 2800 ° С Магнезият се използва също и в медицинската практика.
В горивния въздух, заедно с магнезиев оксид нитрид се образува:
Магнезиев метал е по-активен от водород, могат следователно реагират с вода, измествайки водород тях. Реакцията протича при нагряване:
Магнезиев хидроксид е типичен база, много малко разтворим във вода.
С киселини магнезиев реагира много бързо изместване водород;
Сред солите от особен интерес е магнезиев хлорид MgCl2. който служи като суровина за получаване на магнезиев чрез електролиза. В природата на магнезиевия хлорид се намира в състав Е нерала carnallite KCl • MgCl2 • 6N2 О, и се екстрахира от него.
магнезиев карбонат, магнезиев или бяло, се среща в природата като MgCO3 минералната магнезит. както и част от Neko-toryh скали като доломит CaCO3 MgCO3 •. От тях, получен чрез калциниране чист магнезий:
В естествени води настъпва хидрогенкарбонат магнезиев Mg (HCO3) 2. даване на вода твърдост.
Интересни магнезиеви силикати - талк 3MgO • 4SiO2 • Н2 О и азбест 3MgO • 2SiO2 • 2Н2 О, имащи високо пожар на горенето. Азбест е влакнеста структура, така че тя може да се върти и е изработен от облеклото си за тези, които най-високи температури. Магнезиеви силикати, карбонати и неразтворим във вода. Трябва също да се отбележи, че един от най-забележителните положителни общества в природата - зелените пигмент хлорофил растения - с притежаващ около 2,7% магнезий. С помощта на хлорофил прави един от най-важните природни процеси - фотосинтеза. Без маг-ТА не хлорофил, но без хлорофил живота на Земята.
^ Понятието органомагнезиево съединение
Органомагнезиеви съединения съдържат Mg-С връзка; обща формула R2 Mg и RMgX (където R - органичен радикал, X - за предпочитане CI, Br, I). Най-важното RMgX (ВЗАИМОДЕЙСТВА-ви Grignard) - твърди, че поради времето им Coy реактивност се получат и използват като-се случва на въздушните състезания, най-малко - в други органични разтворители.
Метилмагнезиев йодид СН3 Mgl,, метилмагнезиев СН3 MgCl, фенилмагнезиев С6 Н5 MgCl - основния органомагнезиево съединение. Те се използват в органичния синтез (реакция на Grignard), и да се определи активен водород върху мето задачи Tserevitinova.
^ 13.3. Калций и неговите съединения. твърдостта на водата
Да бъдеш в природата
В промишлеността, калциев произведени чрез електролиза на смес от стопени соли: CaCl 2 (75-85%) и КС1 при 700 ° С
Калций - сребристо-бял метал, доста твърдо вещество, да-щеката. Естествен калциев е смес от шест изотопи с масови числа sovymi-40 (основен изотоп), 42, 43, 44, 46 и 48. Изследванията използват изкуствено изотоп Ca 45 20.
Калциев лесно се окислява на въздуха, така че е като калий и натрий, съхранява при керосин слой.
Когато калциев окисление с въздух се образува калциев оксид, или, както е известно, негасена вар (негасена вар) вар СаО:
Подгрятата калциев изгаря в кислород, но не като светло като магнезий. Калциев реагира енергично с гореща вода, измествайки водород тях и образува калциев хидроксид, или гасена вар Са (ОН) 2:
При нормални условия, калций реагира с халоген и сяра, азот и въглероден при нагряване:
Калций, магнезий като проявява изразени нд-stanovitelnye свойства.
Калциев оксид СаО като магнезий, има много висока температура на топене - около 3000 ° С
В промишлеността, калциев оксид, получен чрез изпичане варовици от креда или други карбонатни скали:
Ако CaO излее вода, това е много бурна реакция, придружена-Nied от съскане, силно отделяне на топлина и увеличаване на обема. Хидратираните форми на съобщението в този процес - Са (ОН) 2:
Смес гасена вар, пясък и вода се нарича строител Nym или хоросан. Той се използва като shtu-katurki и за свързване на тухли в зидани стени, въпреки че в последния случай, обикновено се използва цимент.
Втвърдяване се среща в хаван, резултатите са едновременно поток от два процеса:
1) утаяване от свръхнаситен разтвор на калциев хидроксид кристали, които се свързват здраво пясъчните частици заедно;
2) образуването на калциев карбонат чрез реакция:
Гасена вар - бяло твърдо вещество, разтворим във вода-ма, но неговата разтворимост е ниска. Разтвор на гасена вар във вода се нарича вар вода. Той има алкален свойства. При преминаване през разтвор на вар вода CO2 става мътен и изчезва с допълнително преминаване мътност:
Вар вода се използва като реагент на въглероден оксид (IV) и за отстраняване на временната твърдост на водата vyzy-Vai калциев карбонат Са (HCO3) 2.
Летливи калций багрило съединение в пламъка на горелката тухла-червен цвят.
Както е известно, в естеството на чиста вода, практически не се среща etsya - в нейната структура винаги съдържа йони на различни соли. Вода, където съставът съдържа много Са Mg 2. 2. 2. Sr Fe. наречен здраво, твърдост на водата и причинява Xia главно Са 2 и Mg 2. йони в твърда вода, сапун mylitsya лошо лоши сварени меки зеленчуци, и по време на използването им като вода SRI в парни котли образува мащаб, което може да доведе до експлозия на котела. Твърдата вода преди ядене-niem трябва да се смекчи. Разграничаване карбонат и се регулира до твърдост стайна-nekarbo вода.
Карбонат нарича твърдост на водата поради Xia съдържащ в тях водородни карбонати на калций и магнезий. Когато кипене унищожени солите да образуват слабо разтворим въглерод-позиция, и йони Са 2 и Mg 2 отстранява от разтвор:
Ето защо, карбонатна твърдост често се нарича временна твърдост на водата.
Noncarbonate скованост се определя в присъствието на вода и сулфати на калциеви и магнезиеви хлориди, не се прехвърлят за да се утаи под обратен хладник прост и поради това се нарича постоянна твърдост на водата. За да се премахне калций и магнезий се утаява от сода:
През последните години, за да се елиминира твърдостта на водата йонообменители са широко използвани.