Законите на химичните свойства на елемента
Законите на химичните свойства на елементите и връзките им с периоди и групи
Списък на моделите на промяна в свойствата изложени в рамките на периода:
- метални свойства са намалени;
- неметални свойства са подобрени;
- степента на окисление на елементи в по-високите оксиди увеличава от $ + $ 1 до $ + 7 $ ($ + 8 за $ $ $ Os и Ru $ $);
- степента на окисление на елементите в летливи съединения с водородни увеличава от $ -4 до $ $ $ 1;
- основни оксиди на амфотерен заменя с киселинен оксид;
- от алкални хидроксиди се заменят с амфотерни киселини.
Д. И. Менделеев в $ 1869 $, сключения - формулира периодичния закон, който гласи, както следва:
Свойствата на химичните елементи и техните съединения се образуват в периодична функция на относителните атомните маси на елементи.
Систематизиране химични елементи на базата на относителните атомни маси Менделеев обърне особено внимание като свойствата на елементи и съединения, образувани от тях, разпространение елементи с подобни свойства в вертикални колони - група.
Понякога те идентифицирани модел нарушение, Менделеев поставя тежки елементи с по-малки стойности на относителната атомна маса. Например, тя се записва в таблица пред кобалт никел, телур, йод преди, и когато се отвори инертен (благороден) газ - аргон преди калий. Този ред на подреждане на Менделеев счита за необходимо, защото в противен случай тези елементи да попадат в групата на различни елементи в тях свойства, особено калий на алкален метал ще удари групата на инертни газове, и инертен газ е аргон - от групата на алкалните метали.
D. I. Менделеев не може да обясни тези изключения от общото правило, и не може да обясни причината за причината на периодичността свойства на елементи и съединения, образувани от тях. Въпреки това, той прогнозира, че причината се крие в сложната структура на атома, на вътрешната структура на които не е бил известен по това време.
В съответствие със съвременните концепции за атомна структура, в основата на класификацията на химични елементи са обвиненията на техните ядра, и сегашната формулировка на периодичния закон е както следва:
Свойствата на химични елементи и вещества, образувани от тях са в периодично зареждане в зависимост от техните атомни ядра.
Честота промени в свойствата на елементи от периодичната повторение е обяснено в структурата на външни енергийни нива на атома. Това е броят на енергийните нива, общият брой на електрони, разположени върху тях, както и броя на електрони външно отразява получените символи в периодичната таблица, т.е. разкрие физически смисъла на период номер, номер на група и серийния номер на елемента.
Структурата на атома и може да обясни причините за промяната на метални и неметални свойства на елементи в групи и периоди.
Периодично право и Периодичната таблица на елементите D. I. Mendeleeva обобщава информация за химични елементи и вещества, образувани от тях и обясни периодичността в промяната на техните свойства и причината за сходството на свойствата на елементи от една и съща група. Двете най-важни ценности на периодичния закон и периодичната система допълва един от друг, което е способността да се предскаже, т.е. предскаже и описват свойствата да се уточни начинът, по откриването на нови химични елементи.
Общи характеристики на металите на основните подгрупи I ± III групи по отношение на тяхната позиция в периодичната система на химичните елементи D. I. Mendeleeva и структурни характеристики на техните атоми
Химични елементи - метални
Повечето химични елементи се отнасят до метали - $ 92 $ $ 114 $ от известни елементи.
Всички метали, с изключение на живак в нормално състояние - твърдите вещества и имат редица общи свойства.
Метали - ковък, ковък, ковък вещество с метален блясък и може да провежда топлина и електричество.
Атомите на метални елементи външни даряват електрони (и някои predvneshnego) електронен слой, преминавайки положителни йони.
Това свойство на метални атоми, както знаете, се определя от факта, че те имат сравнително голям радиус и малък брой електрони (обикновено от $ 1 до $ $ $ 3 на външния слой).
Единствените изключения са $ 6 $ метали германий атома, калай, олово, на външния слой са $ 4 $ електрон на атомите на антимон и бисмут - $ 5 $ атоми полоний - $ 6 $.
За метални атоми, характеризиращи се с малки стойности на Електроотрицателност (от 0,7 $ до 1,9 $ $ $) и изключително редуциращи свойства, т.е. способност да дарят електрони.
Вече знаете, че в периодичната таблица на химичните елементи Г. И. Mendeleeva метали са под диагонал Бор - астатин, а над него, в подгрупите. Периодите и основните подгрупи са известни модели промените в метала, а оттам и намаляване свойства елемент атома.
Химични елементи, разположени близо до диагонала бор - астатин ($ Be, Al, Ti, Ge, Nb, Sb $), има двойно свойства: някои от техните съединения се държат като метали, други метали проявяват свойства.
Подгрупите на регенеративни свойства на метали с увеличаване атомен номер често намалени.
Това може да се обясни с факта, че електроните в силата на валентна връзка с ядрото на атомите на тези метали в голяма степен засяга степента на ядрения заряд, не атомната радиус. Големината на ядрената таксата се увеличава значително, привличането на електроните да се увеличава ядрото. Радиусът на атома в същото време, въпреки че се увеличава, но не толкова значително, както в основната група метали.
Прости вещества образувани от химични елементи - метали и сложни, съдържащи метали, вещества играят важна роля в минерални и органични "живот" на Земята. Достатъчно е да се припомни, че атомите (йони) на метални елементи са компонент на съединения, които определят метаболизма при хора и животни. Например, установено $ 76 $ клетки в човешка кръв, от които само $ 14 $ не са метали. При хора, някои elements- метали (калций, калий, натрий, магнезий) присъства в голямо количество, т.е. Те са макроклетки. Метал като хром, манган, желязо, кобалт, мед, цинк и молибден присъстват в малки количества, т.е. тази следа.
Налични метали основни подгрупи групи I-III.
Алкални метали - основна група метал в група I. Техните атоми в нивото на външната енергия са един електрон. Алкални метали - силни редуциращи агенти. Техните reducibility и реактивоспособност нараства с увеличаване на атомния номер на елемента (т.е., забавяне на Периодичната таблица). Всички те разполагат с електронна проводимост. Якостта на връзката между атоми на алкалните метали се намалява с увеличаване на атомния номер на елемента. Също така намалява техните топене и кипене точки. Алкални метали реагират с много прости вещества - оксиданти. В реакции с вода образуват разтворими база вода (алкален).
Алкалоземни елементи се наричат елементи на основната подгрупа на група II. Атомите на тези елементи, съдържащи се върху външната енергийно ниво на два електрона. Те са редуциращи агенти, да има степен на окисление на $ 2 + $. В тази подгрупа основните общи модели наблюдавани при промяна на физическите и химическите свойства, свързани с увеличаване на размера на атомите в групата от отгоре надолу, както и отслабване на химичната връзка между атомите. С увеличаване на размера на йон-слаби киселинни и основни свойства са подобрени оксиди и хидроксиди.
Подгрупа III основни елемента групи съдържат бор, алуминий, галий, индий и талий. Всички елементи са $ р $ -elements. На нивото на външната енергия, те имат три $ (а ^ 2p ^ 1) $ на електрона, което обяснява приликата на имотите. Степента на окисление + $ 3 $. В рамките на групата от метал с увеличаване на такса свойства на увеличението на ядрото. Бор - неметални елемент, като алуминий има метални свойства. Всички елементи, които образуват оксиди и хидроксиди.
Характеризиране на преходни елементи ± мед, цинк, хром, желязо според тяхното положение на Периодичната система на елементите D. I. Mendeleeva и структурните характеристики на техните атоми
Повечето от металните елементи в странична група на периодичната система.
В четвърти период на калиеви и калциеви атоми, има четвърти електронен слой попълнено $ 4s $ -poduroven, тъй като тя е по-ниска енергия от $ 3d $ -poduroven. $ К, Са - S $ са елементи, принадлежащи към основната група. Y атоми към $ Sc $ $ Zn $ запълнени с електрони $ 3d $ -poduroven.
Помислете за това, което сили действат на електрона, който се добавя към един атом с увеличения ядрени заряда. От една страна, привличането на атомното ядро, което води до електроните заемат най-ниското ниво на свободни енергия. От друга страна, отблъскването съществуващата електрони. Когато нивото на енергия е $ 8 $ електрони (заети и $ s-$ $ $ р орбитали), общата им отблъскващ ефект толкова много, че на следващия електрона влиза вместо енергията под $ d-$ орбитална на по-високо $ s-$ орбитален на следващото ниво. Електронна структура на външни енергийни нива на калия $. 3d ^ 4s ^ 1 $ за калций - $. 3d ^ 4s ^ 2 $.
Следван от добавянето на още един електрон в скандий води до началото $ попълване $ 3d орбитална вместо все още по-високи енергия $ 4P $ орбитали. Той е енергично благоприятно. Пълнене $ 3d $ орбитите на завършва на цинк, която има електронен структура на $ 1s ^ 2s ^ 2P ^ 3S ^ 3P ^ 3d ^ 4S ^ 2 $. Трябва да се отбележи, че елементите на мед и хром наблюдавани явления на "недостатъчност" електрон. В меден атом десета $ г $ -electron премине към третия $ 3d $ -poduroven.
E формула меден $. 3d ^ 4s ^ 1 $. В атомите хром в четвъртото ниво на енергия ($ S $ орбитална) трябва да бъде $ 2 $ на електрона. Въпреки това, един от двата електрона са прехвърлени на трето ниво на енергия в незапълнени орбитална $ г $, $ своя електрон формула. 3d ^ 4s ^ 1 $.
По този начин, за разлика от основната група елементи, при което постепенно запълване на външната електрон орбитали атомно ниво на страничните елементи на подгрупи пълни $ г $ предпоследното ниво орбитална енергия. Затова името на: $ г $ -elements.
Всички прости вещества образуват елементи от подгрупите на Периодичната система са метали. Поради големия брой на атомна орбитала от метални елементи на основните подгрупи атоми $ г $ -elements образуват голям брой химични връзки между тях и следователно създават по-твърда решетка. Тя е по-силна и механично, както и с оглед на отоплителните. Затова метали вторични подгрупи - най-трайни и рефрактерни на всички метали.
Известно е, ако атом, има повече от три валентните електрони, елементът показва променлива валентност. Това се отнася за повечето от $ -elements на $ г. Тяхната максимална валентност, както и елементите на основната група, е номерът на група (въпреки че има изключения). Елементи със същия брой на валентните електрони са в групата със същия брой $ (Fe, Co, Ni) $.
До $ г $ -elements променя свойствата на техните оксиди и хидроксиди, в същия срок, движещи се от ляво на дясно, т.е. да се увеличи тяхната валентност е получен от основните свойства на киселинна амфотерен чрез. Например, хром има валентност $ + 2, 3, + $ 6; и неговите оксиди: $ $ СгОз - основен, $ Cr_O_3 $ - амфотерни, $ CrO_3 $ - киселина.
Общи характеристики на неметални основна група IV ± VII групи по отношение на тяхната позиция в периодичната система на химичните елементи D. I. Mendeleeva и структурни характеристики на техните атоми
Химични елементи - неметали
Първата научна класификация на химичните елементи са ги разделя на метали и неметали. Тази класификация не е загубил значението му в момента.
Неметали - са химични елементи за атома, която е характерна способност да приема електрони до завършване поради наличието на външния слой, обикновено от външната електрон слой четири или повече електрони и атоми на малък радиус сравнение с метални атоми.
Това определение оставя настрана основните елементи на група VIII подгрупа - инертни или благородни газове, чиито атоми са завършили външен електронен слой. Електронната конфигурацията на атомите на тези елементи е, че те не могат да бъдат приписани на металите или не-метали. Те са тези обекти, които споделят елементи на метали и неметали, като границата между тях позиция. Инертните или благородни газове ( "благороден", изразени в инерция), понякога се нарича неметали, но не официално, на физически причини. Тези вещества запазват газообразно състояние до много ниски температури. По този начин, не се втечнява при хелий $ т ° = -268,9 ° C $.
Химически инертност на тези елементи е относително. За ксенон и криптон са известни съединения с флуор и кислород :. $ KrF_2, XeF_2, XeF_4 $ т.н. Без съмнение, образуването на тези съединения, инертни газове действат като редуктори.
От определението на неметали, че за техните атоми имат висока стойност електроотрицателност. Тя варира от $ 2 до $ 4 $ $. Неметали - главен група елементи, предимно $ R $ -elements, с изключение на водород - S-елемент.
Всички елементи, неметални (различни от водород) заемат Периодичната система на елементите D. I. Mendeleeva горния десен ъгъл, триъгълник, на върха на която е флуоро $ F $ и основата - диагонал $ Б - В $.
Въпреки това, трябва да се наблегне на двойната позиция водород в периодичната таблица: В големите подгрупи I и VII групи. Това не е случайно. От една страна, водороден атом, атом на алкален метал като има от външната страна (и само на него) електрон един електрон слой (електронен конфигурация $ 1s ^ $ 1), който е в състояние да даде, показва свойства на редуциращ агент.
В повечето от техните водородни съединения, такива като алкални метали и проявява степен на окисление на $ 1 + $. Но откат електрон водороден атом настъпва по-трудно, отколкото металните атоми алкални. От друга страна, водороден атом, като халогенни атоми, до приключване на външен електронен слой липсва един електрон, така че водородният атом може да приеме един електрон, показва свойства на окислител и характеристика халоген окисляване състояние - $ 1 $ хидриди (съединения на метали, такива съединения халоген-метал - халиди). Но закрепването на един електрон да водороден атом настъпва по-трудно от халогени.
Обект атома елементи - неметали
В неметални атоми доминират окислителни свойства, т.е. способност да прикачите електрони. Тази способност е характерно електроотрицателност стойност, която варира редовно в периоди и подгрупи.
Флуоро - най-мощният окислителя на неговите атоми в химични реакции не е в състояние да даряват електрони, т.е. покаже намаляване свойства.
Конфигурацията на външните слоеве на електрони.
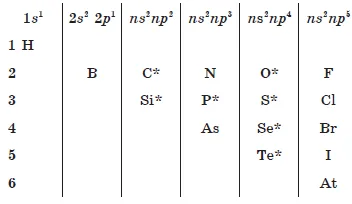
В периода:
- увеличаване на ядрената такса;
- атомен радиус намалява;
- броят на електроните в външни увеличава слой;
- електроотрицателност увеличава;
- окислителни свойства са подобрени;
- неметални свойства са подобрени.
Основните подгрупи:
- увеличаване на ядрената такса;
- атомните увеличава радиус;
- броят на електрони във външния слой не се променя;
- електроотрицателност намалява;
- окислителни свойства са отслабени;
- неметални свойства отслабват.
Други неметали могат да проявяват намаляване свойства, макар и в много по-малка степен в сравнение с метали; в периоди и подгрупи устойчивост варира в обратен ред в сравнение с окислителя.
Химични елементи, неметални $ 16 $! Съвсем малко, ако вземем предвид, че ние знаем, $ 114 $ елементи. Две неметални елементи съставляват 76 $% $ масата на земната кора. Този кислород (49 $% $) и силиций (27 $% $). Атмосферата съдържа 0,03 $ $% маса кислород в земната кора. Неметали са 98,5 $% $ тегло на растенията, 97,6 $% $ тегло на човешкото тяло. Неметали $ С, Н, О, N, S, Р $ - органогенни които образуват основните органични вещества на живи клетки: протеини, мазнини, въглехидрати, нуклеинови киселини. В състава на въздуха, който се вдишва включват прости и сложни вещества като образуват елементи, неметали (O_2 $ $ кислород, азот $ N_2 $, въглероден диоксид SO_2 $ $, водна пара N_2O $ $ и др.).