взаимодействието на въртене орбита - химически енциклопедия
Spin орбита взаимодействие. взаимодействие между магнит. моменти, свързани с въртенето и орбитални моменти разчитат движение на електрони и ядра в системата на квантовата - атом. молекула. кристал и т.н. Приносът на спин-орбитално взаимодействие на енергията кара системата да отговори на три ром условията на Hamiltonian в Ур Шрьодингер. Първият план се дължи на магнезий. поле, възникнало на относително преместване на електронни ядра по електротехника. поле, действащо от ядрото и се върти Magn. време; вторият е с магнит. поле, възникнал по време на движението на електрона по електротехника. сфера на всички други електрони. трети или с взаимодействието. върти магнит. време на електрони с магнезий. полета, създадени от всички други електрони в тяхното движение.
За електрони, аз и й с радиус вектори ри и RJ и варива (миг движение броене) пи и PJ им спин-орбитално взаимодействие един с друг и с жилата и обвиненията към-ryh равни Z а (от гледна точка на елементарната такса д ) и радиус вектори на R а. Това води до по-добавка. принос към Хамилтонов на системата, състояща се от следните неща. три суми:
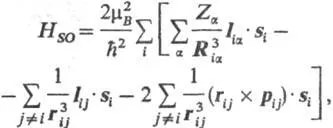
От тези суми, обикновено DOS. принос за енергия на системата осигурява на първо място, а на втория и третия (те са обикновено се нарича ". взаимодействието на спина-орбитална на другия") даде много по-малък принос. Ако те пренебрегва взаимодействието на спин-орбита е както следва:
някъде Fct координати на електрони и ядра, както и ядрата на такси. Тези FCT пропорционални, така че, когато средният им всички възможни позиции naib електрони. тези конфигурации съществено система в к-ryh електрони са близо до ядра. Ако молекулата на вълна е-ЛИЗАЦИЯ оформен на мол. орбитали под формата на линейна комбинация от атомни орбитали (вж. LCAO приближение), средните стойности на главните интеграли принос изчислени с атомна орбитала на около в центъра на сърцевината на (cm. Orbital). Обикновено Fct за атоми е заместен с nek- константи, които зависят от главния п и л орбитални квантово число (Ri R а.); те се обади. постоянни взаимодействия спин-орбита. Водородните атоми е пропорционална Z 4 и п е обратно пропорционална на 3. В мулти-електрон атоми настъпва защитни електрони ядрото и зависимост постоянно въртене орбита взаимодействие на Z и п става по-слабо изразен и функционално по-сложна. Въпреки това, в този и в друг случай, спин-орбита взаимодействието Naib. вътр голям за електроните. черупки от тежки атоми. докато молекулите за вътр. черупки от атомни ядра, което позволява на функции на плътността от спин-orbitalnoh взаимодействия и молекули, използвайки атомни константи
С ПИН-орбиталния взаимодействие води до разделяне на нивата на изродени мултиплет, които са представени в атомната и мол. спектри като фина структура. По този начин, поради взаимодействието на спин орбита нисш възбуден ниво на алкални метални атоми е разделена на две: 2 P1 / 2 и 2 P3 / 2. където индексът показва общия ъглов момент квантовата броя на брой електрони движението във външното. направо обвивка. За Na (Z = 11, п = 3), това разделяне е 17,2sm -1. за К (Z = 19, п = 4) 57.7 cm -1. за Cs (Z = 55, п = 6) 554.1 cm-1. В халогенни атоми разделяне NP-нива на електрони още по-постоянен и спин-орбитално взаимодействие е както следва: F до 272 ст-1. за С, 587 ст-1. I до 5060 см-1. За достатъчно силен спин-орбитално взаимодействие на концепцията за множеството от гледна точка обикновено губи значението си и се счита за един брой на пълно работно време на движението на електрони. и не предат и орбитален ъглов момент отделно. Забрана на квантовата преходи между нивата на различни множество в присъствието на спин-орбитално взаимодействие се отстранява, което води, например. да фосфоресцираща - излъчва. преход от състояния с живота са обратно пропорционално на квадрата на матричните елементи на взаимодействието на спин орбита, и по-terkombinats. превръщане (вж. Луминисценцията. фотохимична реакция). От времето на светене зависи не само директно от време живота състояние "фосфоресциращ" на молекулите. но също така и от средата, в рояк, те са, за да се вземе предвид тази зависимост се въвежда идеята за междумолекулни спин-орбитално взаимодействие. Двуатомен и линеен полиатомен молекули съотношението на взаимодействието на спин орбита и др. Взаимодействия, например. спин-въртене, тя ви позволява да изберете декември При завъртане връзка. орбитален и др. мигове (вж. комуникационни случаи Hund), която дава възможност за провеждане на комуникации за всеки отделен случай специфичност. класификация квантови състояния на молекулата.
В израз за HSO не е представена термин, съответстващ взаимодействие. Ядрена магнит. върти ъглов момент и орбитален ъглов момент на електроните. Когато а.с. а (Ri а) =, G A-G-ядро фактор. М Н - Магне тон ядрени, аз един - ядрен спин. Свързани с този термин разделяне нива значително по-малко отколкото в резултат на свързването на спин орбита; напр. за електронно състояние 2 P1 / 2 Na атом а.с. стойност от 94.5 MHz, и за състоянието 2 P3 / 2 -19.1 MHz, т.е. около 0,003-0,001 см1. Обикновено, член I се изолира (заедно с други. Членове на същия порядък) в орбитален свръхфин взаимодействието. или свръхфиното ядрено-магнитен. взаимодействие, показано на спектрите ESR (cm. електронен парамагнитен резонанс).
Литература см. по чл. Spin. NV Степанов.
