Верижна реакция (Chemistry)

За първи път терминът "верижна реакция" е предложен от немски химик и физик Макс Bodenstein. гр., които в 1913 установено, че в някои фотохимични реакции (например, взаимодействие на водород с хлор, за да се образува хлороводород и хлор с въглероден монооксид за образуване фосген) абсорбция на еднофотонна води до взаимодействие на стотици хиляди молекули на изходните материали. Както вече бе разбирането, че всеки абсорбира фотон е способен само една частица, беше заключено, че останалата част от реакциите на верига, причинени от активни частици без по-нататъшно включване на светлина кванти. Като такъв активен частици Bodenstein препоръчва възбудени молекули Cl2 * хлор. и през 1916 г., друг немски химик W. Нернст предполага, че активните частици са атомни в природата. Той също предложи серия схема на реакцията на хлорни и водородни молекули (неразклонена верига реакция):
Последователно трансформация верига, в която запазва активна частица (Cl • или Н •), може да включва много молекули на изходните реагенти (Cl2 и Н2), докато брутната формула на реакцията отразява стехиометрията на реакцията:
Теорията на верижни реакции
Признаци на верижни реакции
- Реакцията се ускорява в присъствие на инициатори, с разпадане един инициатор молекула води до превръщането на няколко реагенти молекули.
- Реакцията се инициира чрез действието на светлина или йонизиращо лъчение, с квантов добив по-голям от 1.
- Реакцията се инхибира от инхибитори и скорост инхибитор поток много по-малка от скоростта на задръжки реакция.
терминология
А верижна реакция се провежда с участието на активни центрове - свободни радикали, атома, възбудени молекули, които участват в процеса на верига. Реакцията може да доведе един активен сайт (например, в случай на радикалова полимеризация):
или повече, например, в реакции сулфоксидиращо:
R ⋅ + SO 2 → RSO 2 ⋅ \ стрелкаНадясно RSO_ \ cdot >>> RSO 2 ⋅ + O 2 → RSO 4 ⋅ \ cdot + O_ \ стрелкаНадясно RSO_ \ cdot >>> RSO 4 ⋅ + RH → RSO 4 Н + R ⋅ \ cdot + RH \ стрелкаНадясно RSO_H + R \ cdot >>> започване (зародиши) верига
Етап започване верига е образуването на активните частици са склонни да се прекъсне химични връзки. Този етап е най-енергоемки и протича при високи температури, излагане на светлина, йонизиращо лъчение, ускорени електрони, и в присъствие на инициатори - вещества с дисоциация химична връзка енергия на по-малко енергия прекъсване химична връзка изходни материали. Такива вещества са различни радикални инициатори, например азобисизобутиронитрил. бензоил пероксид. kumilgidroperoksid и други вещества, което се случва при разцепване отопление homolytic връзка за производство на активни радикали, като се започне верижна реакция.
Също така образувани верижни реакции могат да служат електронен трансфер процеси, като например реагент на Фентън FeSO4 - Н 2О 2:
За разлика от това, катализатори, инициаторите да се консумират по време на реакцията.
Продължава верига включва взаимодействие с молекулите на активни центрове изходен реагенти, които реакционни продукти се образуват и запазват активен център. удължаване на веригата е възможно поради изпълнението на принципа на нерушимост свободна валентна в активните места на взаимодействие с valentnonasyschennymi молекули.
Връзка във веригата е последователност от действия на продължаване на веригата, който завършва в първоначалния вид на активен център. В случай на реакция на хлор с водород като действа две реакция сулфоксидиращо - три.
При отворена верига настъпва разрушаване на активния център. Изчезването на свободната валенция в следните случаи:
- прекратяване квадратичен верига поради взаимодействието на двете активни центрове един с друг. Необходимо е да се сблъсък с трета частица, която пренася на реакция енергия
- взаимодействие с активния център на молекулата, при което радикал неактивен, можеше да продължи веригата - хомогенна прекратяване линейна верига
- взаимодействие с активния център на повърхността (например, съдът или твърди частици) - линеен прекратяване хетерогенна верига:
дължина на веригата се нарича общия брой на връзки в реакциите на верижни удължители, които настъпват в един радикал, в резултат на поколение верига. Ако β - вероятност на верига терминатори, (1-β) - вероятността за растеж верига и дължина на веригата ν е:
където VP - процент верижна реакция разширение, VT - отворен скорост верига. При достатъчно високо β дължина на веригата е малък, така че
Реакциите на неразклонени вериги във всеки елементарен акт реакция произвежда един активен сайт на една от активния център. Процесът на формиране на множество активни центрове по време на начално събитие наречен разклоняване верижни реакции.
Кинетика на реакции неразклонени вериги
Активните частици, участващи в реакцията на верига са много активни и реагират бързо с реагентите и молекули един към друг. В резултат на динамично равновесие на системата е установено между скоростта на образуване на активните частици и тяхната смъртност и концентрацията на активните сайтове R • става почти неподвижно:
и скоростта на започване на веригата VI равна на тяхната чупене скорост VI:
В случай на прекратяване на линейна верига
скорост на реакция прекратяване е равно на
и квази-стационарна концентрация от радикалите R •
За прекратяване квадратното верига
Условия дълги вериги: ЗП скорост на веригата е много по-голяма от скоростта на започване и прекратяване на веригата. В този случай, изчисляването на концентрацията на активно формиране на сайтове и загуба на активните сайтове пренебрегвани.
За верижната реакция на хлор с водород
Пример неразклонен верижна реакция - пиролиза на етан:
Условия дълги вериги:
Освен всички етапи характерни неразклонена верига реакции разклонени верижни реакции имат един или повече етапи на верига разклоняване, че може да възникне по различни механизми.
Този тип на разклоняване наблюдава, например, водород в реакцията на горене:
Н ⋅ + O 2 → О Н ⋅ + О. \ стрелкаНадясно ОН \ cdot + O: >>> О. + Н 2 → Н О ⋅ + Н ⋅ \ стрелкаНадясно HO \ cdot + Н \ cdot >>> мощност разклоненияПолучено: в случай на образуване на високоенергийни частици, по-специално в реакцията на водород с флуор да образуват водороден флуорид възбудени молекули и пренос на енергия от него към молекулата на водород:
За реакции разклонена верига, се характеризират с постоянни и нестабилни режими на възникването му. В първия етап скоростта случай счупване над верига разклоняване етап скорост, така че почти неподвижно концентрацията на активните сайтове при относително малка дълбочина на константа на реакцията. Ако степента на разклоняване на веригата превишава тяхната скорост на счупване, концентрацията на активни центрове в системата бързо се увеличава, и има взрив верига. Той също така се характеризира с възпаление преход верига в термична експлозия, ако отстраняването на топлината от системата е възпрепятствано.
Скоростта и дълбочината на реакцията в преходен режим често експресират Semenov уравнение:
където φ - разклонение на веригата фактор: разликата между скоростите на разклоняване и прекъсване на веригата в изчислението за една активна позиция. Условия ф = 0 е границата за прехода в нестабилна режим.
Възможността за преместване на разклонена верига реакцията от стационарен режим на преходни определя критични условия, при които разклонението и прекратяване верига са равни скорост. Този преход настъпва, когато концентрацията на реагентите, температурата, размера съд, и въвеждането на примеси, дори и когато е разреден с инертен газ система.
Ефект на налягане на газовата фаза режим система разклонена верига реакция се определя от три зони:
- Зоната на ниско налягане - скоростта на прекъсване на веригата е доста висока, поради дифузия на активните центрове и загубата на стените на кръвоносните съдове, скоростта на реакцията е ниско
- Зоната на повишено налягане - поради дифузия е възпрепятствано активни места и степента на растеж на концентрацията на реагентите надвишава верига разклоняване скорост счупване се ускори реакцията и реакционната смес възпаление - долната граница на самозапалване
- Зоната на високо налягане - поради високата концентрация на активни центрове увеличава квадратна част на терминиране на веригата реакции в тримолекулен и в някои реакция налягане отново протича в стационарната режим - горната граница на самозапалване.
С повишаване на температурата, регион запалване между долната и горната граница на запалване разширява поради увеличената вероятност, че енергийната верига разклоняване, докато отворена верига скорост се променя малко. С намаляване на температурата, долните и горните граници на запалване се обединяват в една точка. В резултат на това зависимостта на границите на запалване на температурата има характерен вид, наречен п запалване.
Чрез този механизъм разклоняване радикали, образувани от продукти молекулни реакции, и може да се разглежда като система, в която инициатор натрупва защото скоростта на разпадане е по-малко скорост верига трансфер. Такъв механизъм е наблюдавано при окисление на въглеводороди с атмосферен кислород (автоокисляване) за образуване хидропероксиди:
Тъй като образуването на хидропероксид и homolytic реакционни разлагане увеличава скоростта - положителна обратна връзка се осъществява. Скоростта на реакцията е описан от уравнението
инхибиране
Представяне инхибитори може значително да забавят процесите радикални верижни. По отношение на реакциите на автооксидирането на въглеводороди от механизма на действие на инхибитори са разделени в три класа:
Инхибитори взаимодействат с пероксидни радикали
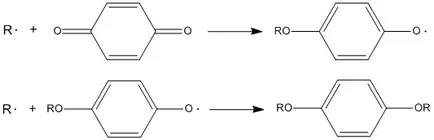
Тези инхибитори включват феноли. ароматни амини. аминофеноли, хидроксиламшш. както и полициклични ароматни въглеводороди. Тези вещества могат да прекъсне веригата на процеса на веригата от 2 до образуване на по-малко активни радикални и молекулярни продукти:
I п Н + R О 2 ⋅ → R О О Н + I п ⋅ \ cdot \ стрелкаНадясно ROOH + В \ cdot >>> I п ⋅ + R О 2 ⋅ → P \ cdot \ стрелкаНадясно P >>> инхибитори, взаимодейства с алкилови радикали
Скоростта на реакцията на автоокисляване на въглеводороди се увеличава с концентрацията на хидропероксиди в тях, обаче добавянето на вещества, реагиращи с хидропероксиди (например, сулфиди дисулфиди.) за да се образува молекулни продукти автоокисляване процеси значително забавя:
R 1 OOH + R 2 S → R 1 OH + R 2 SO OOH + R_S \ стрелкаНадясно R_OH + R_SO >>> R 1 OOH + RSSR → R 1 OH + RS (O) SR OOH + RSSR \ стрелкаНадясно R_OH + RS ( О) SR >>>